前四周期元素 A、B、C、D、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状 态;基态 B 原子 s 能级的电子总数比 p 能级的多 1;基态 C 原子和基态 E 原子中成对电子数均是未成对电 子数的 3 倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1) E 的元素名称为________ 。
(2)元素 A、B、C 中,电负性最大的是________ (填元素符号,下同),元素 B、C、D 第一电离能由大到小的顺序为________ 。
(3)与同族其它元素 X 形成的 XA3相比,BA3易液化的原因是________ ;BA3分子中键角________ 109°28'(填“>”“<”或“=”),请写出与BA3互为等电子体的一个离子________ 。
(4)BC3 离子中 B 原子轨道的杂化类型为________ ,BC3 离子的立体构型为________ 。
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图 所示)相似。若 DB 的晶胞参数为 a pm,则晶体的密度为________ g·cm−3(用NA表示阿伏加 德罗常数)。

(1) E 的元素名称为
(2)元素 A、B、C 中,电负性最大的是
(3)与同族其它元素 X 形成的 XA3相比,BA3易液化的原因是
(4)BC3 离子中 B 原子轨道的杂化类型为
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图 所示)相似。若 DB 的晶胞参数为 a pm,则晶体的密度为

更新时间:2020/03/28 11:06:52
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】黄铜矿(CuFeS2)是炼铜的主要矿物,在野外很容易被误会为黄金,因此被称为愚人金。回答下列问题:
(1)处于激发态的S原子,其中1个3s电子跃迁到3p轨道上,该激发态S原子的核外电子排布式为__ 。同族元素的氢化物中,H2O比H2Te沸点高的原因是__ 。
(2)检验Fe2+的试剂有多种,其中之一是铁氰化钾(K3[Fe(CN)6]),又称赤血盐。
①在配合物K3[Fe(CN)6]中,易提供孤电子对的成键原子是__ (填元素名称),含有12molσ键的K3[Fe(CN)6]的物质的量为__ mol。
②赤血盐中C原子的杂化方式为__ ;C、N、O三种元素第一电离能由大到小的排序为___ ;写出与CN-互为等电子体的一种化合物的化学式__ 。
③Fe、Na、K的晶胞结构相同,但钠的熔点比钾更高,原因是___ 。
(3)CuFeS2的晶胞结构如图所示。已知:晶胞参数a=0.524nm,c=1.032nm。则CuFeS2的晶胞中每个Cu原子与__ 个S原子相连,晶体密度ρ=__ g·cm-3(列出计算表达式)。
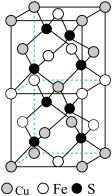
(1)处于激发态的S原子,其中1个3s电子跃迁到3p轨道上,该激发态S原子的核外电子排布式为
(2)检验Fe2+的试剂有多种,其中之一是铁氰化钾(K3[Fe(CN)6]),又称赤血盐。
①在配合物K3[Fe(CN)6]中,易提供孤电子对的成键原子是
②赤血盐中C原子的杂化方式为
③Fe、Na、K的晶胞结构相同,但钠的熔点比钾更高,原因是
(3)CuFeS2的晶胞结构如图所示。已知:晶胞参数a=0.524nm,c=1.032nm。则CuFeS2的晶胞中每个Cu原子与

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式________________________ 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为_______ 个、_______ 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为______________ 、_______ (各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。
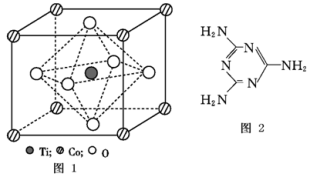
三聚氰胺分子中氮原子轨道杂化类型是______ ,1 mol三聚氰胺分子中σ键的数目为_______ 。
(1)写出基态Mn原子的核外电子排布式
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。

三聚氰胺分子中氮原子轨道杂化类型是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
解题方法
【推荐3】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____ 周期第_____ 族。
(2)N的基态原子核外电子排布式为_____ ;Cu的基态原子最外层有___ 个电子。
(3)用“>”或“<”填空:
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
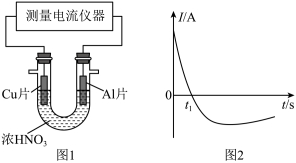
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____ ,溶液中的H+向___ 极移动,t1时,原电池中电子流动方向发生改变,其原因是______ 。
(1)Si位于元素周期表第
(2)N的基态原子核外电子排布式为
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al | N | 金刚石 | CH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是
您最近半年使用:0次
【推荐1】技术人员晒制蓝图时,用K3[Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6](六氯合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为第四周期第_______ 族;Fe3+的基态价电子排布图为_______ 。
(2)在上述两种钾盐中第一电离能最大的元素为_______ (填化学式),电负性最小的元素为_______ (填化学式)。
(3)H2C2O4分子中碳原子的杂化类型是_______ ,与C2O 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为_______ (写一种)。
(4)已知C60分子结构和C60晶胞如下图所示:
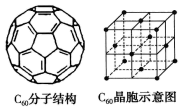
①如图所示,1个C60分子中参与形成π键的电子总数为_______ 。
②如图所示,固体C60的晶体类型为_______ 。
③已知C60晶胞参数(即所示整个立方体晶胞的边长)为a pm,则该晶胞密度的表达式是_______ g·cm-3(NA代表阿伏加德罗常数)。
(1)铁元素在周期表中位置为第四周期第
(2)在上述两种钾盐中第一电离能最大的元素为
(3)H2C2O4分子中碳原子的杂化类型是
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(4)已知C60分子结构和C60晶胞如下图所示:

①如图所示,1个C60分子中参与形成π键的电子总数为
②如图所示,固体C60的晶体类型为
③已知C60晶胞参数(即所示整个立方体晶胞的边长)为a pm,则该晶胞密度的表达式是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为___________ 。
②Si所在周期中的非金属元素(稀有气体除外),其第一电离能由小到大的顺序为___________ 。
③写出一种与SiCl4互为等电子体的离子的化学式___________ 。
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为___________ 。
②从键的形成角度分析1键和2键的区别:___________ 。
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH CH3CH2OH
CH3CH2OH
①AlH 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
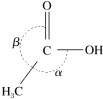
②CH3COOH分子中π键和σ键的数目之比为___________ ,分子中键角α___________ (填“>”、“=”或“<”)键角β。
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:
①晶胞中Al的配位数是___________ ,若该晶胞的边长为a nm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值)
②晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,该数组称为该原子的原子坐标,如晶胞中N原子①的原子坐标为( ,
, ,
, ),试写出晶胞中Al原子的原子坐标
),试写出晶胞中Al原子的原子坐标___________ (任填一个位置)
(1)①基态Si原子的价电子排布式为
②Si所在周期中的非金属元素(稀有气体除外),其第一电离能由小到大的顺序为
③写出一种与SiCl4互为等电子体的离子的化学式
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为
②从键的形成角度分析1键和2键的区别:
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH
 CH3CH2OH
CH3CH2OH①AlH
 的VSEPR模型名称是
的VSEPR模型名称是②CH3COOH分子中π键和σ键的数目之比为

(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:


①晶胞中Al的配位数是
②晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,该数组称为该原子的原子坐标,如晶胞中N原子①的原子坐标为(
 ,
, ,
, ),试写出晶胞中Al原子的原子坐标
),试写出晶胞中Al原子的原子坐标
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D是元素周期表中前四周期的元素,其中A元素p电子总数比s电子总数少1; B元素p电子总数与s电子总数相等,且原子半径比A小;C元素原子3p能级上只有一对成对电子;D元素原子N层上只有1个电子,且次外层的电子充满在2个能级中。请回答以下问题:
(1)写出下列元素的名称:A______ D________ 。
(2)元素A、B可以形成A2B型共价化合物,写出一种与A2B等电子体的化合物________ (用化学式表示)
(3)A和B第一电离能的大小关系为:A____ B。(选填“>”、“<”或“ = ”)
(4)B和C元素对应的气态氢化物,沸点较高的是______ (填化学式),原因是______________ 。
(1)写出下列元素的名称:A
(2)元素A、B可以形成A2B型共价化合物,写出一种与A2B等电子体的化合物
(3)A和B第一电离能的大小关系为:A
(4)B和C元素对应的气态氢化物,沸点较高的是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性: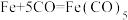 。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为
。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为 。回答下列问题:
。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是___________ (填标号)。
a. b.
b.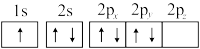
c.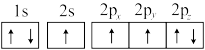 d.
d.
(2)写出CO的一种常见等电子体分子的结构式:___________ ;C、N、O的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)与N同族的元素还有P、As,它们氢化物的沸点大小为___________ ,其原因是___________ 。
(4)配合物 中,铜显+1价,则其中碳原子的杂化轨道类型是
中,铜显+1价,则其中碳原子的杂化轨道类型是___________ , 分子的价层电子对互斥理论模型是
分子的价层电子对互斥理论模型是___________ 。
(5)已知铜的一种氧化物 晶体的晶胞结构如图所示:
晶体的晶胞结构如图所示:

①若坐标参数A为(0,0,0),C为( ,
, ,
, ),则B的坐标参数为
),则B的坐标参数为___________ 。
②若阿伏加德罗常数的值为NA,该晶胞的边长为a pm,则晶体的密度为___________ g/cm3。
 。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为
。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为 。回答下列问题:
。回答下列问题:(1)下列氮原子的电子排布图表示的状态中,能量最低的是
a.
 b.
b.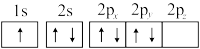
c.
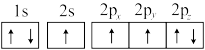 d.
d.
(2)写出CO的一种常见等电子体分子的结构式:
(3)与N同族的元素还有P、As,它们氢化物的沸点大小为
(4)配合物
 中,铜显+1价,则其中碳原子的杂化轨道类型是
中,铜显+1价,则其中碳原子的杂化轨道类型是 分子的价层电子对互斥理论模型是
分子的价层电子对互斥理论模型是(5)已知铜的一种氧化物
 晶体的晶胞结构如图所示:
晶体的晶胞结构如图所示:
①若坐标参数A为(0,0,0),C为(
 ,
, ,
, ),则B的坐标参数为
),则B的坐标参数为②若阿伏加德罗常数的值为NA,该晶胞的边长为a pm,则晶体的密度为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
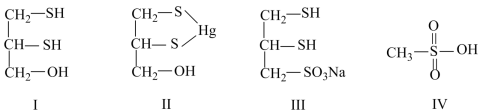
(1)H2S、CH4、H2O 沸点由高到低顺序为
沸点由高到低顺序为_______ 。
(2)汞的原子序数为80,位于元素周期表中的位置是_______ 。
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV_______ 硫酸(填“>”或“<”)
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有_______ 。
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是_______ 。(填“化合物I”或“化合物Ⅲ”)

(1)H2S、CH4、H2O
 沸点由高到低顺序为
沸点由高到低顺序为(2)汞的原子序数为80,位于元素周期表中的位置是
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。请用化学用语 回答下列问题:
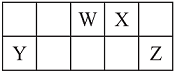
(1)写出W含有8个中子的核素的化学符号_____________ 。
(2)元素Z的最高价氧化物对应的水化物的化学式为_____________ 。
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为________________ 。
(4)X、Z的气态氢化物沸点较高是________ ,原因是____________________ 。
(5)化合物Y2X3中含有的化学键类型是________ 。工业上冶炼Y单质的方法是________ (填字母)。
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是___________________________________ 。

(1)写出W含有8个中子的核素的化学符号
(2)元素Z的最高价氧化物对应的水化物的化学式为
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为
(4)X、Z的气态氢化物沸点较高是
(5)化合物Y2X3中含有的化学键类型是
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】高熵合金通常被定义为含有5种以上主要元素的固溶体,每种元素的摩尔比为5%~35%.这个概念已经扩展到创造熵稳定的功能材料中.此类材料有熵稳定高熵功能材料(Mg、Co、Ni、Cu、Zn的氧化物),以及尖晶石、碳化物和硅化物等.根据所学知识回答下列问题:
(1)镍及其化合物常用作有机合成的催化剂,如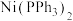 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为_______ ﹔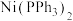 晶体中存在的化学键类型有
晶体中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(2)尖晶石是镁铝氧化物组成的矿物,含有铁,锌,锰等元素,Fe、Mn、Zn三种元素的第一电离能由大到小的顺序为_______ 。
(3)已知: 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成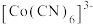 ,
,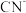 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_______ ,该离子中C的杂化方式为_______ 。
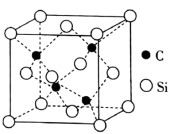
(4)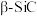 的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为
的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为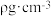 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为_______ (用含a、b、 ,
, 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)镍及其化合物常用作有机合成的催化剂,如
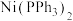 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为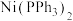 晶体中存在的化学键类型有
晶体中存在的化学键类型有A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(2)尖晶石是镁铝氧化物组成的矿物,含有铁,锌,锰等元素,Fe、Mn、Zn三种元素的第一电离能由大到小的顺序为
(3)已知:
 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成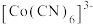 ,
,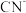 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为(4)
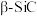 的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为
的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为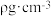 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为 ,
, 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C、D、E是原子序数依次增大的前四周期元素,A是短周期中族序数等于周期数的非金属元素,B元素形成的化合物种类最多;D的最外层电子数与电子层数之比为3∶1;E是第四周期元素,最外层只有一个电子,其余各层电子均充满。请回答下列问题(用元素符号或化学式表示):
(1)E在周期表中位于__________ 区,E+的电子排布式为__________________________ 。
(2)D元素原子的价层电子排布图为___________________ ,A2D2的电子式为____________ ,分子中D原子杂化类型为______________ 。
(3)元素B、C、D的基态原子的电负性由大到小的顺序为___________________________ ,A分别与B、C、D能形成电子10的化合物,它们的沸点由高到低的顺序是__________ (写分子式)。
(4)C2A4在碱性溶液中能够将ED还原为E2D,已知当1mol C2A4完全参加反应时转移了4 mol电子,则该反应的化学方程式可表示为:___________________ 。
(5)已知EA晶体结构单元如图所示(A原子在体对角线的1/4处),该化合物的密度为ρg·cm-3,阿伏伽德罗常数的值为NA,则该晶胞中E原子与A原子之间的最短距离为_______ cm(用含ρ和NA的式子表示)。

(1)E在周期表中位于
(2)D元素原子的价层电子排布图为
(3)元素B、C、D的基态原子的电负性由大到小的顺序为
(4)C2A4在碱性溶液中能够将ED还原为E2D,已知当1mol C2A4完全参加反应时转移了4 mol电子,则该反应的化学方程式可表示为:
(5)已知EA晶体结构单元如图所示(A原子在体对角线的1/4处),该化合物的密度为ρg·cm-3,阿伏伽德罗常数的值为NA,则该晶胞中E原子与A原子之间的最短距离为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。铁是生活中最常见的金属材料。
(1)铜原子在基态时的价电子排布式为_________ ,铁在周期表中的位置为__________ 。
(2)与铁处于同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素共有_____ 种。
(3)砷与氮在周期表中位于同族,画出砷的价电子排布图_____________________ 。
(4) AsF3的立体构型名称是______________ ,As的杂化类型为________ 。
(5)下列三个反应在某密闭容器中进行:
① Fe(s)+CO2(g)= FeO(s)+CO(g) △H1=a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=b kJ·mol-1
③ 2Fe(s)+O2(g)= 2FeO(s) △H3=___________ (用含a、b表示)kJ·mol-1
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______________________ (用化学式表示)。
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,其晶胞的边长为361.5pm,立方氮化硼的密度是d g·cm-3,则:阿伏加 德罗常数(NA)=________________ (只要求列算式,不必计算出数值)。
(1)铜原子在基态时的价电子排布式为
(2)与铁处于同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素共有
(3)砷与氮在周期表中位于同族,画出砷的价电子排布图
(4) AsF3的立体构型名称是
(5)下列三个反应在某密闭容器中进行:
① Fe(s)+CO2(g)= FeO(s)+CO(g) △H1=a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=b kJ·mol-1
③ 2Fe(s)+O2(g)= 2FeO(s) △H3=
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,其晶胞的边长为361.5pm,立方氮化硼的密度是d g·cm-3,则:阿伏加 德罗常数(NA)=
您最近半年使用:0次



