解题方法
1 . 化学兴趣小组在探究金属镁与稀盐酸反应的放热现象时,小明同学把打磨好的约 长的镁条卷起后放在小试管中,滴加几滴稀盐酸,用手触碰试管外壁,发现试管外壁发热镁条表面有气泡产生。此外,小明还观察到溶液变浑浊,有少量白色沉淀产生。
长的镁条卷起后放在小试管中,滴加几滴稀盐酸,用手触碰试管外壁,发现试管外壁发热镁条表面有气泡产生。此外,小明还观察到溶液变浑浊,有少量白色沉淀产生。
(1)镁条表面产生气泡的原因________ (用化学方程式表示)。
探究一:白色沉淀的产生
[提出问题]为什么产生白色沉淀?
[设计实验]分别取用打磨好的约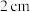 长的镁条卷起后放在1到8号8支小试管中,用相同的胶头滴管分别向8支小试管中滴入5滴、10滴、20滴、30滴、40滴、50滴、60滴、70滴、70滴稀盐酸,观察现象。
长的镁条卷起后放在1到8号8支小试管中,用相同的胶头滴管分别向8支小试管中滴入5滴、10滴、20滴、30滴、40滴、50滴、60滴、70滴、70滴稀盐酸,观察现象。
[交流讨论]
(2)由上表数据可知,沉淀的产生及多少与________ 有关。
探究二:白色沉淀的成分
[提出猜想]
(3)依据质量守恒定律,白色沉淀可能是:a.从镁条上脱落下来的镁的小颗粒;b.________ ;c.可能是其他物质。
[实验验证
(4)验证猜想a:把有浑浊物的试管中的浑浊液体倒入另一支试管中,________ 。
验证猜想b:把有浑浊物的试管中的浑浊液体倒入另一支试管中,加入足量的蒸馏水,观察沉淀是否溶解。
[实验结论]猜想a和猜想b都不成立。白色沉淀到底是什么物质呢?
[反思评价]
(5)老师指出,在镁与盐酸的反应中,当盐酸不足量时会生成碱式氯化镁的白色沉淀。而且,由于 的影响,溶液中的
的影响,溶液中的 不同,碱式氯化镁
不同,碱式氯化镁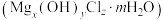 的组成成分也不同。因此,做该实验时,应选用的酸是
的组成成分也不同。因此,做该实验时,应选用的酸是________ ;如果选用稀盐酸,也要注意镁带的用量宜少不宜多。
 长的镁条卷起后放在小试管中,滴加几滴稀盐酸,用手触碰试管外壁,发现试管外壁发热镁条表面有气泡产生。此外,小明还观察到溶液变浑浊,有少量白色沉淀产生。
长的镁条卷起后放在小试管中,滴加几滴稀盐酸,用手触碰试管外壁,发现试管外壁发热镁条表面有气泡产生。此外,小明还观察到溶液变浑浊,有少量白色沉淀产生。(1)镁条表面产生气泡的原因
探究一:白色沉淀的产生
[提出问题]为什么产生白色沉淀?
[设计实验]分别取用打磨好的约
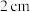 长的镁条卷起后放在1到8号8支小试管中,用相同的胶头滴管分别向8支小试管中滴入5滴、10滴、20滴、30滴、40滴、50滴、60滴、70滴、70滴稀盐酸,观察现象。
长的镁条卷起后放在1到8号8支小试管中,用相同的胶头滴管分别向8支小试管中滴入5滴、10滴、20滴、30滴、40滴、50滴、60滴、70滴、70滴稀盐酸,观察现象。| 试管编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 盐酸用量/滴 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 沉淀量 | 沉淀很多 | 沉淀较多 | 沉淀较少 | 无沉淀 | ||||
(2)由上表数据可知,沉淀的产生及多少与
探究二:白色沉淀的成分
[提出猜想]
(3)依据质量守恒定律,白色沉淀可能是:a.从镁条上脱落下来的镁的小颗粒;b.
[实验验证
(4)验证猜想a:把有浑浊物的试管中的浑浊液体倒入另一支试管中,
验证猜想b:把有浑浊物的试管中的浑浊液体倒入另一支试管中,加入足量的蒸馏水,观察沉淀是否溶解。
[实验结论]猜想a和猜想b都不成立。白色沉淀到底是什么物质呢?
[反思评价]
(5)老师指出,在镁与盐酸的反应中,当盐酸不足量时会生成碱式氯化镁的白色沉淀。而且,由于
 的影响,溶液中的
的影响,溶液中的 不同,碱式氯化镁
不同,碱式氯化镁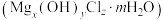 的组成成分也不同。因此,做该实验时,应选用的酸是
的组成成分也不同。因此,做该实验时,应选用的酸是
您最近一年使用:0次
24-25九年级上·全国·假期作业
解题方法
2 . 某兴趣小组的同学设计实验探究红砖粉对过氧化氢溶液分解反应能否起催化作用:
 、B试管中均盛等体积等浓度的过氧化氢溶液;
、B试管中均盛等体积等浓度的过氧化氢溶液;
 向A中加入1克红砖粉,分别将带火星的木条放置在A、B试管口,A管口木条复燃,B管口木条不复燃;
向A中加入1克红砖粉,分别将带火星的木条放置在A、B试管口,A管口木条复燃,B管口木条不复燃;
 反应结束后,将A中混合物过滤、洗涤、烘干得到滤渣;
反应结束后,将A中混合物过滤、洗涤、烘干得到滤渣;
 观察滤渣的颜色和状态;
观察滤渣的颜色和状态;
 称量滤渣的质量为1克;
称量滤渣的质量为1克;
 将滤渣加入到B试管中,伸入带火星木条,木条复燃。
将滤渣加入到B试管中,伸入带火星木条,木条复燃。
请回答:
(1)在探究过程中做的是______ 实验。
(2)通过实验 你得出的结论是:
你得出的结论是:______ 。
(3)设计实验 的目的是:
的目的是:______ 。
(4)若省掉步骤 能否达到实验目的?
能否达到实验目的?______  你的理由是
你的理由是______ ;若省掉步骤 能否到达实验目的?
能否到达实验目的?______  你的理由是
你的理由是______ 。
 、B试管中均盛等体积等浓度的过氧化氢溶液;
、B试管中均盛等体积等浓度的过氧化氢溶液; 向A中加入1克红砖粉,分别将带火星的木条放置在A、B试管口,A管口木条复燃,B管口木条不复燃;
向A中加入1克红砖粉,分别将带火星的木条放置在A、B试管口,A管口木条复燃,B管口木条不复燃; 反应结束后,将A中混合物过滤、洗涤、烘干得到滤渣;
反应结束后,将A中混合物过滤、洗涤、烘干得到滤渣; 观察滤渣的颜色和状态;
观察滤渣的颜色和状态; 称量滤渣的质量为1克;
称量滤渣的质量为1克; 将滤渣加入到B试管中,伸入带火星木条,木条复燃。
将滤渣加入到B试管中,伸入带火星木条,木条复燃。请回答:
(1)在探究过程中做的是
(2)通过实验
 你得出的结论是:
你得出的结论是:(3)设计实验
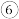 的目的是:
的目的是:(4)若省掉步骤
 能否达到实验目的?
能否达到实验目的? 你的理由是
你的理由是 能否到达实验目的?
能否到达实验目的? 你的理由是
你的理由是
您最近一年使用:0次
名校
解题方法
3 . 下列实验方案设计正确的是
A.测定空气中氧气含量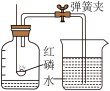 |
B.探究催化剂对过氧化氢分解的影响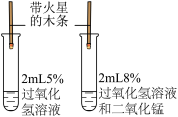 |
C.细铁丝在氧气中燃烧 |
D.测定稀硫酸的pH |
您最近一年使用:0次
4 . 食用油是厨房中常见的食材,小组同学针对食用油的变质问题进行了探究。
I.认识食用油
(1)从六大营养素角度分析,食用油富含的基本营养素是_______ 。
(2)特丁基对苯二酚,英文简称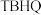 ,其化学式为
,其化学式为 ,是国际上公认最好的食品抗氧化剂之一,且有防霉,抗菌作用。在该物质中
,是国际上公认最好的食品抗氧化剂之一,且有防霉,抗菌作用。在该物质中_______ 元素的质量分数最大。
Ⅱ.检验食用油是否变质
【查阅资料】
①食用油不易溶于水,能溶于酒精和醋酸中。白酒和白醋的主要成分分别为酒精和醋酸。
②食用油变质后产生的过氧化物可使碘化钾淀粉试纸从白色变为蓝色。
(3)由实验组可知,用于检验食用油是否变质适宜的溶剂为_______ 。经检验,已经明显变质的油样是_______ 。某同学对实验提出质疑,认为没有检验两种溶剂是否能使碘化钾淀粉试纸变色,实验不严密,你认为该同学的质疑是否合理,并说明理由:_______ 。
Ⅲ.去除食用油中过氧化物的方法
(4)设计实验2-1的目的是_______ 。
(5)由实验2-2得到的结论是_______ 。
(6)请设计一个实验方案探究有氧环境对去除食用油中过氧化物的影响_______ 。
I.认识食用油
(1)从六大营养素角度分析,食用油富含的基本营养素是
(2)特丁基对苯二酚,英文简称
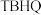 ,其化学式为
,其化学式为 ,是国际上公认最好的食品抗氧化剂之一,且有防霉,抗菌作用。在该物质中
,是国际上公认最好的食品抗氧化剂之一,且有防霉,抗菌作用。在该物质中Ⅱ.检验食用油是否变质
【查阅资料】
①食用油不易溶于水,能溶于酒精和醋酸中。白酒和白醋的主要成分分别为酒精和醋酸。
②食用油变质后产生的过氧化物可使碘化钾淀粉试纸从白色变为蓝色。
| 实验操作 |
| |||||
| 实验序号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 | 1-6 |
| 溶剂 | 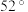 白酒 白酒 | 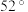 白酒 白酒 | 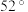 白酒 白酒 | 白醋 | 白醋 | 白醋 |
| 油样 | 新油 | 过期油 | 煎炸过的老油 | 新油 | 过期油 | 煎炸过的老油 |
| 现象 | 碘化钾淀粉试纸不变色 | 碘化钾淀粉试纸不变色 | 碘化钾淀粉试纸不变色 | 碘化钾淀粉试纸不变色 | 碘化钾淀粉试纸变为蓝色 | 碘化钾淀粉试纸轻微变蓝 |
(3)由实验组可知,用于检验食用油是否变质适宜的溶剂为
Ⅲ.去除食用油中过氧化物的方法
| 实验方法 | 2-1隔绝氧气自降解法 | 2-2还原降解法 |
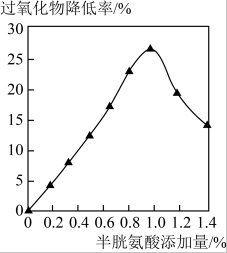
| 实验操作 | 在隔绝氧气条件下,取四份相同体积、不同温度的食用油,分别恒温放置,每隔一段时间测定油样的过氧化值。 |  时,取若干份相同体积的食用油,添加不同质量的还原剂(半胱氨酸),测定油样的过氧化值。 时,取若干份相同体积的食用油,添加不同质量的还原剂(半胱氨酸),测定油样的过氧化值。 |
| 实验结果 |
|
|
(4)设计实验2-1的目的是
(5)由实验2-2得到的结论是
(6)请设计一个实验方案探究有氧环境对去除食用油中过氧化物的影响
您最近一年使用:0次
5 . 生活中我们食用果蔬前需要清洗,化学小组进行下列实践活动,探究不同清洗剂及方法清洗果蔬的效果。
【查阅资料】果蔬表面的残留,主要是植物生长过程中使用的杀虫剂等物质,常见杀虫剂多数呈酸性,少数为碱性或中性;
任务一:比较生活中几种常见清洗方法的效果
【进行实验】取等量未施加杀虫剂的小白菜,进行“模拟施药处理”后,分别用以下方法清洗(清洗时间等相关条件均相同),再通过检测机构检测小白菜表面杀虫剂的残留率,数据如下表所示;
【讨论交流】
(1)“模拟施药处理”的操作是:分别向各组小白菜表面均匀喷洒等量___________(填标号)
(2)根据实验___________ (填标号)数据,可初步推测小白菜表面的杀虫剂显酸性;
(3)上述实验,不能得出“浸泡时在水中添加其它物质清洗效果更好”的结论,证据是_______ ;
(4)在本实验中,最适宜清洗小白菜的方法为___________ ;
任务二:探讨某果蔬清洗盐的清洗效果
除以上方法外,生活中还会用果蔬清洗盐来清洗果蔬,某市售蛋壳类果蔬清洗盐(以下简称“清洗盐”)产品标签部分内容如下;
(5)瓜果表面的人工果蜡中含有石蜡,根据石蜡的物理性质及清洗盐的成分和使用方法推测,该产品能除去人工果蜡,可能的原因有___________ (写出两点);
(6)某同学对该清洗盐“高效去杀虫剂”的功效提出质疑,理由是___________ ;
【拓展延伸】
小组同学为了验证该清洗盐的成分并确定各成分的质量比,设计如下实验方案;
资料:氢氧化钙在一定温度下能分解生成氧化钙和水蒸气;___________ ;
(8)通过测定上述方案中清洗盐质量 、
、 质量
质量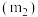 及固体质量
及固体质量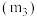 ,即可达成实验目的.试剂X为
,即可达成实验目的.试剂X为___________ ,所取清洗盐中氢氧化钙的质量为___________ (用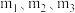 表示).。
表示).。
【查阅资料】果蔬表面的残留,主要是植物生长过程中使用的杀虫剂等物质,常见杀虫剂多数呈酸性,少数为碱性或中性;
任务一:比较生活中几种常见清洗方法的效果
【进行实验】取等量未施加杀虫剂的小白菜,进行“模拟施药处理”后,分别用以下方法清洗(清洗时间等相关条件均相同),再通过检测机构检测小白菜表面杀虫剂的残留率,数据如下表所示;
| 实验组 | ① | ② | ③ | ④ | ⑤ |
| 清洗方法 | 不清洗 | 清水冲洗 | 清水浸泡 | 纯碱溶液浸泡 | 食盐水浸泡 |
| 杀虫剂残留率 | 44.74% | 2.53% | 34.21% | 18.42% | 42.11% |
(1)“模拟施药处理”的操作是:分别向各组小白菜表面均匀喷洒等量___________(填标号)
| A.相同浓度的同一种杀虫剂 | B.相同浓度的不同种杀虫剂 | C.不同浓度的同一种杀虫剂 |
(2)根据实验
(3)上述实验,不能得出“浸泡时在水中添加其它物质清洗效果更好”的结论,证据是
(4)在本实验中,最适宜清洗小白菜的方法为
任务二:探讨某果蔬清洗盐的清洗效果
除以上方法外,生活中还会用果蔬清洗盐来清洗果蔬,某市售蛋壳类果蔬清洗盐(以下简称“清洗盐”)产品标签部分内容如下;
| ××蛋壳类果蔬清洗盐 【功效】除果蜡 高效去杀虫剂 除虫卵 【成分】蛋壳提取物(碳酸钙、氧化钙和氢氧化钙) 【使用方法】取适量清洗盐加入水中,再放入瓜果,轻轻揉搓并浸泡3分钟 |
(5)瓜果表面的人工果蜡中含有石蜡,根据石蜡的物理性质及清洗盐的成分和使用方法推测,该产品能除去人工果蜡,可能的原因有
(6)某同学对该清洗盐“高效去杀虫剂”的功效提出质疑,理由是
【拓展延伸】
小组同学为了验证该清洗盐的成分并确定各成分的质量比,设计如下实验方案;
资料:氢氧化钙在一定温度下能分解生成氧化钙和水蒸气;
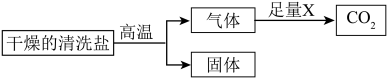
(8)通过测定上述方案中清洗盐质量
 、
、 质量
质量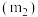 及固体质量
及固体质量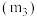 ,即可达成实验目的.试剂X为
,即可达成实验目的.试剂X为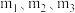 表示).。
表示).。
您最近一年使用:0次
名校
解题方法
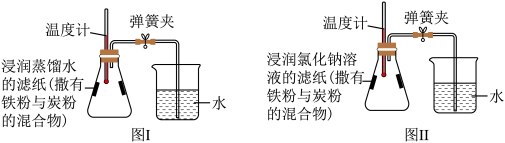
6 . 某化学兴趣小组在实验室中进行铁的锈蚀实验,选用的试剂有铁粉与炭粉的混合物、氯化钠溶液、蒸馏水、两张同样大小的滤纸,将两张滤纸分别浸润氯化钠溶液和蒸馏水,然后向两张滤纸撒上等质量的铁粉与炭粉的混合物,按如图所示装置(气密性均良好)进行实验。
(2)实验过程中,与图I装置比较,图Ⅱ装置中温度计读数上升幅度明显,其原因是什么?
(3)请结合该实验,举例说明铁的锈蚀对人类有利的一面。
(2)实验过程中,与图I装置比较,图Ⅱ装置中温度计读数上升幅度明显,其原因是什么?
(3)请结合该实验,举例说明铁的锈蚀对人类有利的一面。
您最近一年使用:0次
7日内更新
|
54次组卷
|
3卷引用:2024年海南省儋州市中考模拟化学试题
7 . 丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
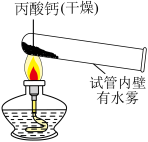
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
【解释与结论】
(1)由①中现象说明丙酸钙一定含有_____ 元素。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。在实验②中,若要证明①中冷却后的固体里含有碳酸盐,则烧杯中A溶液的溶质是_____ 。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
【解释与结论】
(3)第1组,③中X为_____ 。
(4)设计第2组实验的目的是_____ 。
(5)在①-⑧实验中,能证明“有无蔗糖对丙酸钙防霉效果无影响”的所有实验组合是_____ 。
【反思与评价】
(6)结合生活经验,你对日常使用的食品添加剂有什么看法:_____ (一条即可)。
Ⅰ.探究丙酸钙的性质
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
| 序号 | ① | ② |
| 装置 |
|
|
(1)由①中现象说明丙酸钙一定含有
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。在实验②中,若要证明①中冷却后的固体里含有碳酸盐,则烧杯中A溶液的溶质是
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
| 组别 | 第1组 | 第2组 | |||||||
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 配方 | 面粉/g | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| 酵母/g | 0.75 | 0.75 | X | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | |
| 蔗糖/g | 0 | 0 | 0 | 0 | 5 | 5 | 5 | 5 | |
| 丙酸钙/g | 0 | 0.06 | 0.10 | 0.15 | 0 | 0.06 | 0.10 | 0.15 | |
| 开始发霉时间 | 第3天 | 第4天 | 第5天 | 第6天 | 第3天 | 第4天 | 第5天 | 第6天 | |
(3)第1组,③中X为
(4)设计第2组实验的目的是
(5)在①-⑧实验中,能证明“有无蔗糖对丙酸钙防霉效果无影响”的所有实验组合是
【反思与评价】
(6)结合生活经验,你对日常使用的食品添加剂有什么看法:
您最近一年使用:0次
解题方法
8 . 定性实验和定量实验是化学中常见的两种实验方法。
(1)工业上用CO炼铁,利用了CO的______ 性。
(2)打磨后的铝丝放入硫酸铜溶液中观察得到有红色物质析出。说明金属活动性Al______ Cu(填“>”或“<”)。打磨铝丝的目的是______ 。
(3)向等体积的5%H2O2分别加入等质量且颗粒大小相同Fe2O3和MnO2作催化剂,现象如下表:
分析上表可得到的结论是:______ 。
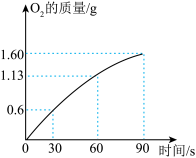
(4)往H2O2溶液中加入MnO2,反应生成气体的质量与时间的关系如图所示,求反应90s时消耗H2O2的质量。(写出计算过程)
(1)工业上用CO炼铁,利用了CO的
(2)打磨后的铝丝放入硫酸铜溶液中观察得到有红色物质析出。说明金属活动性Al
(3)向等体积的5%H2O2分别加入等质量且颗粒大小相同Fe2O3和MnO2作催化剂,现象如下表:
| 催化剂 | 现象 |
| MnO2 | 有大量气泡 |
| Fe2O3 | 少量气泡 |
(4)往H2O2溶液中加入MnO2,反应生成气体的质量与时间的关系如图所示,求反应90s时消耗H2O2的质量。(写出计算过程)
您最近一年使用:0次
解题方法
9 . 化学是以实验为基础的科学,实验是科学探究的重要手段。
(2)实验室利用B装置制取二氧化碳的化学方程式为_______ 。B装置作为气体发生装置其优点是______ ;若用D装置收集二氧化碳,气体应从______ (选填“b”或“c”)端进入。
(3)实验室制得的二氧化碳中常含有少量的氯化氢气体与水蒸气,若要制取一瓶较为纯净、干燥的CO2,所选用装置的正确连接顺序为B→______→______C。______
探究制氧机的原理:
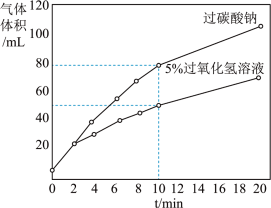
查阅资料:过氧化氢和过碳酸钠都可以产生氧气。理论上生成150mL氧气,分别需要5%的过氧化氢溶液7.6mL,过碳酸钠1.4g。
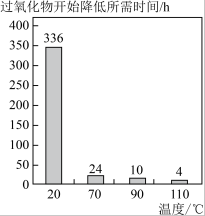
(4)小组同学取上述两种药品分别加入0.2g二氧化锰进行对比实验,比较过氧化氢溶液和过碳酸钠制取氧气的效率,测得数据如图(20min后几乎不产生氧气)请分析制氧剂选择过碳酸钠的依据是______ ;写出实验室制取氧气的化学方程式为________ 。

| A.烧杯 | B.量筒 | C.试管 | D.蒸发皿 |
(2)实验室利用B装置制取二氧化碳的化学方程式为
(3)实验室制得的二氧化碳中常含有少量的氯化氢气体与水蒸气,若要制取一瓶较为纯净、干燥的CO2,所选用装置的正确连接顺序为B→______→______C。
探究制氧机的原理:
查阅资料:过氧化氢和过碳酸钠都可以产生氧气。理论上生成150mL氧气,分别需要5%的过氧化氢溶液7.6mL,过碳酸钠1.4g。
(4)小组同学取上述两种药品分别加入0.2g二氧化锰进行对比实验,比较过氧化氢溶液和过碳酸钠制取氧气的效率,测得数据如图(20min后几乎不产生氧气)请分析制氧剂选择过碳酸钠的依据是
您最近一年使用:0次
2024九年级·广东广州·专题练习
10 . 肥皂是常见的清洁用品。实验小组以废油脂为原料制备肥皂,并探究影响肥皂制备效果的因素。
【查阅资料】
1.肥皂的主要成分是脂肪酸盐,可由油脂与碱反应制得。
2.肥皂制备效果用皂化率衡量,皂化率越高,制备效果越好。
【进行实验】
取50g废油脂于反应器中,一定温度下,滴加由一定质量NaOH固体配制的30%NaOH溶液,反应4小时,进行处理,测定皂化率。结果如表:
【解释与结论】
(1)NaOH溶液中,溶剂是_____ 。
(2)配制NaOH溶液时,用玻璃棒不断搅拌的作用是______ 和加速散热。
(3)当混合液的pH范围为9~10时,说明反应完全。此时混合液呈______ (填“酸性”“中性”或“碱性”)。
(4)肥皂制备效果与反应温度的关系是_____ 。
【反思与评价】
(5)依据实验数据,不能得出“反应温度等其他条件相同时,NaOH固体质量越大,肥皂制备效果越好”的结论,其证据是______ 。
(6)继续实验,发现反应时间对肥皂制备效果有影响。补全实验方案:取50g废油脂于反应器中,_________ 。
【查阅资料】
1.肥皂的主要成分是脂肪酸盐,可由油脂与碱反应制得。
2.肥皂制备效果用皂化率衡量,皂化率越高,制备效果越好。
【进行实验】
取50g废油脂于反应器中,一定温度下,滴加由一定质量NaOH固体配制的30%NaOH溶液,反应4小时,进行处理,测定皂化率。结果如表:
| 序号 | 反应温度/℃ | 溶液中NaOH的质量/g | 皂化率/% |
| ① | 100 | 10 | 65.06 |
| ② | 100 | 15 | 78.01 |
| ③ | 100 | 20 | 87.95 |
| ④ | 80 | 25 | 95.11 |
| ⑤ | 90 | 25 | 98.63 |
| ⑥ | 100 | 25 | 99.10 |
| ⑦ | 100 | 30 | 98.79 |
(1)NaOH溶液中,溶剂是
(2)配制NaOH溶液时,用玻璃棒不断搅拌的作用是
(3)当混合液的pH范围为9~10时,说明反应完全。此时混合液呈
(4)肥皂制备效果与反应温度的关系是
【反思与评价】
(5)依据实验数据,不能得出“反应温度等其他条件相同时,NaOH固体质量越大,肥皂制备效果越好”的结论,其证据是
(6)继续实验,发现反应时间对肥皂制备效果有影响。补全实验方案:取50g废油脂于反应器中,
您最近一年使用:0次