名校
解题方法
1 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
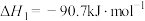

②
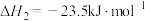

③
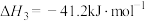

回答下列问题:
(1)反应 的平衡常数K=
的平衡常数K=________ (用 、
、 、
、 表示)。
表示)。
(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施________ 。
(3)一定温度下,将0.2molCO和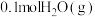 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
________ ,CO的转化率为________ 。
(4)将合成气以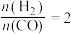 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是________ (填字母)。 B.
B.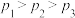 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时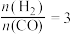 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为________ 时最有利于二甲醚的合成。
①

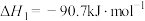

②

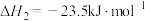

③

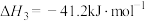

回答下列问题:
(1)反应
 的平衡常数K=
的平衡常数K= 、
、 、
、 表示)。
表示)。(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施
(3)一定温度下,将0.2molCO和
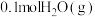 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
(4)将合成气以
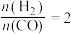 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
图1
A. B.
B.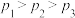 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时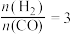 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和
 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为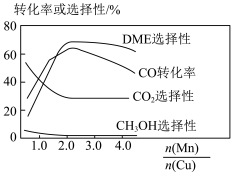
图2
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
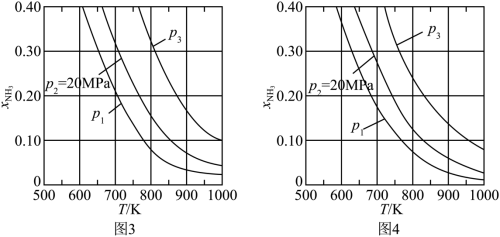
(1)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为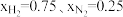 ,另一种为
,另一种为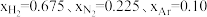 。(物质i的摩尔分数:
。(物质i的摩尔分数: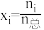 )
)___________ ,判断的依据是___________ 。
②进料组成中含有惰性气体 的图是
的图是___________ 。
③图3中,当 、
、 时,氮气的转化率
时,氮气的转化率
___________ 。该温度时,反应 的平衡常数
的平衡常数
___________  (化为最简式)。
(化为最简式)。
(1)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
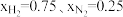 ,另一种为
,另一种为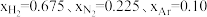 。(物质i的摩尔分数:
。(物质i的摩尔分数: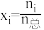 )
)
②进料组成中含有惰性气体
 的图是
的图是③图3中,当
 、
、 时,氮气的转化率
时,氮气的转化率
 的平衡常数
的平衡常数
 (化为最简式)。
(化为最简式)。
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 合成氨厂和硝酸厂的烟气中含有大量的氮氧化物,脱硝是指将烟气中的氮氧化物转化为无毒无害物质的化学过程。回答下列问题:
(1)在一定条件下,向某反应容器中投入5molN2、15molH2在不同温度(T)下发生反应: ,平衡体系中
,平衡体系中 的质量分数随平衡时气体总压强变化的曲线如图所示。
的质量分数随平衡时气体总压强变化的曲线如图所示。___________ 。
②M点时, 的转化率为
的转化率为___________ 。
③下列情况能说明反应达到平衡状态的是___________ (填标号)。
A.2v(NH3)=3v(H2)
B.混合气体的相对分子质量不再变化
C.N2体积分数不再变化
D.恒容容器中混合气体的密度保持不变
(1)在一定条件下,向某反应容器中投入5molN2、15molH2在不同温度(T)下发生反应:
 ,平衡体系中
,平衡体系中 的质量分数随平衡时气体总压强变化的曲线如图所示。
的质量分数随平衡时气体总压强变化的曲线如图所示。
②M点时,
 的转化率为
的转化率为③下列情况能说明反应达到平衡状态的是
A.2v(NH3)=3v(H2)
B.混合气体的相对分子质量不再变化
C.N2体积分数不再变化
D.恒容容器中混合气体的密度保持不变
您最近一年使用:0次
2024高三下·全国·专题练习
4 . 甲醇是重要的化工原料,可以使用多种方法制备甲醇。
(1)利用CO2和H2合成甲醇,在催化剂Cu/ZnO作用下可发生如下两个平行反应。
反应I:CO2(g)+3H2(g)→CH3OH(g)+H2O(g)
反应II:CO2(g)+H2(g)→CO(g)+H2O(g);
温度对CO2转化率及甲醇和CO产率的影响如图乙所示。___________ 。
②由图可知,温度升高CH3OH产率先升高后降低,降低的可能原因是___________ 。
③下列措施有利于提高CO2转化为CH3OH的平衡转化率的有___________ 。
A.增大体系压强
B.提高CO2和H2的投料比
C.体积和投料比不变,提高反应物浓度
(2)利用CH4与O2在催化剂的作用下合成甲醇。主反应:CH4(g)+
 O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性=
O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性= )如图丙所示:
)如图丙所示:___________
②主反应的相对压力平衡常数 =
=___________ 。(用含P和p0的计算式表示。 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
(1)利用CO2和H2合成甲醇,在催化剂Cu/ZnO作用下可发生如下两个平行反应。
反应I:CO2(g)+3H2(g)→CH3OH(g)+H2O(g)
反应II:CO2(g)+H2(g)→CO(g)+H2O(g);
温度对CO2转化率及甲醇和CO产率的影响如图乙所示。
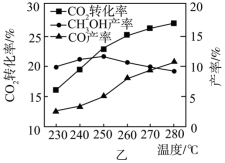
②由图可知,温度升高CH3OH产率先升高后降低,降低的可能原因是
③下列措施有利于提高CO2转化为CH3OH的平衡转化率的有
A.增大体系压强
B.提高CO2和H2的投料比
C.体积和投料比不变,提高反应物浓度
(2)利用CH4与O2在催化剂的作用下合成甲醇。主反应:CH4(g)+

 O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性=
O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性= )如图丙所示:
)如图丙所示:
②主反应的相对压力平衡常数
 =
= 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
您最近一年使用:0次
5 . 已知体积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:
(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为__________ mol/(L·s)。
(2)该反应的平衡常数K=___________ ,若降温其值增大,则该反应的ΔH_____ 0(填“>”或“<”或“=”)。
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为________ L(连通管中气体体积忽略不计,且不考虑温度的影响)。

(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是___________________ ;t6时保持压强不变向体系中充入少量He气,平衡____________ 移动。(填“向左”“向右”或“不”)。

 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为
(2)该反应的平衡常数K=
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为

(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是

您最近一年使用:0次



