1 . 利用 催化加氢合成乙烯可实现
催化加氢合成乙烯可实现 的综合利用。反应方程式为
的综合利用。反应方程式为
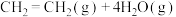 ,在一定压强下,按
,在一定压强下,按 投料反应。平衡时四种组分的物质的量分数x随温度T的变化如图所示。下列有关说法错误的是
投料反应。平衡时四种组分的物质的量分数x随温度T的变化如图所示。下列有关说法错误的是
 催化加氢合成乙烯可实现
催化加氢合成乙烯可实现 的综合利用。反应方程式为
的综合利用。反应方程式为
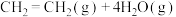 ,在一定压强下,按
,在一定压强下,按 投料反应。平衡时四种组分的物质的量分数x随温度T的变化如图所示。下列有关说法错误的是
投料反应。平衡时四种组分的物质的量分数x随温度T的变化如图所示。下列有关说法错误的是
| A.该反应为放热反应 | B.A点时 |
C.曲线a、b分别表示 、 、 | D.同一温度下 与 与 的转化率始终相等 的转化率始终相等 |
您最近一年使用:0次
名校
解题方法
2 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
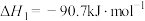

②
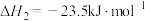

③
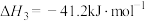

回答下列问题:
(1)反应 的平衡常数K=
的平衡常数K=________ (用 、
、 、
、 表示)。
表示)。
(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施________ 。
(3)一定温度下,将0.2molCO和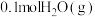 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
________ ,CO的转化率为________ 。
(4)将合成气以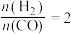 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是________ (填字母)。 B.
B.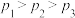 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时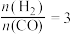 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为________ 时最有利于二甲醚的合成。
①

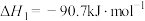

②

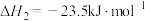

③

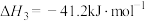

回答下列问题:
(1)反应
 的平衡常数K=
的平衡常数K= 、
、 、
、 表示)。
表示)。(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施
(3)一定温度下,将0.2molCO和
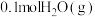 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
(4)将合成气以
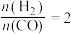 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
图1
A. B.
B.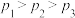 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时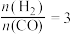 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和
 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为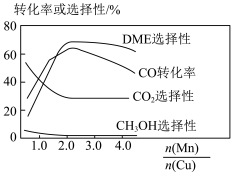
图2
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
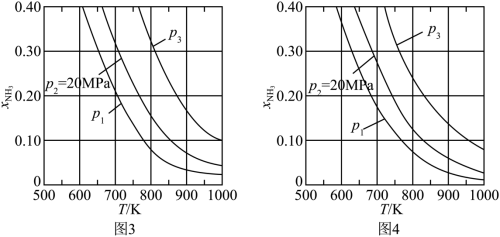
(1)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为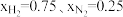 ,另一种为
,另一种为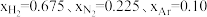 。(物质i的摩尔分数:
。(物质i的摩尔分数: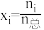 )
)___________ ,判断的依据是___________ 。
②进料组成中含有惰性气体 的图是
的图是___________ 。
③图3中,当 、
、 时,氮气的转化率
时,氮气的转化率
___________ 。该温度时,反应 的平衡常数
的平衡常数
___________  (化为最简式)。
(化为最简式)。
(1)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
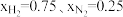 ,另一种为
,另一种为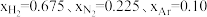 。(物质i的摩尔分数:
。(物质i的摩尔分数: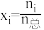 )
)
②进料组成中含有惰性气体
 的图是
的图是③图3中,当
 、
、 时,氮气的转化率
时,氮气的转化率
 的平衡常数
的平衡常数
 (化为最简式)。
(化为最简式)。
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 合成氨厂和硝酸厂的烟气中含有大量的氮氧化物,脱硝是指将烟气中的氮氧化物转化为无毒无害物质的化学过程。回答下列问题:
(1)在一定条件下,向某反应容器中投入5molN2、15molH2在不同温度(T)下发生反应: ,平衡体系中
,平衡体系中 的质量分数随平衡时气体总压强变化的曲线如图所示。
的质量分数随平衡时气体总压强变化的曲线如图所示。___________ 。
②M点时, 的转化率为
的转化率为___________ 。
③下列情况能说明反应达到平衡状态的是___________ (填标号)。
A.2v(NH3)=3v(H2)
B.混合气体的相对分子质量不再变化
C.N2体积分数不再变化
D.恒容容器中混合气体的密度保持不变
(1)在一定条件下,向某反应容器中投入5molN2、15molH2在不同温度(T)下发生反应:
 ,平衡体系中
,平衡体系中 的质量分数随平衡时气体总压强变化的曲线如图所示。
的质量分数随平衡时气体总压强变化的曲线如图所示。
②M点时,
 的转化率为
的转化率为③下列情况能说明反应达到平衡状态的是
A.2v(NH3)=3v(H2)
B.混合气体的相对分子质量不再变化
C.N2体积分数不再变化
D.恒容容器中混合气体的密度保持不变
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 甲醇是重要的化工原料,可以使用多种方法制备甲醇。
(1)利用CO2和H2合成甲醇,在催化剂Cu/ZnO作用下可发生如下两个平行反应。
反应I:CO2(g)+3H2(g)→CH3OH(g)+H2O(g)
反应II:CO2(g)+H2(g)→CO(g)+H2O(g);
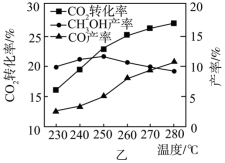
温度对CO2转化率及甲醇和CO产率的影响如图乙所示。___________ 。
②由图可知,温度升高CH3OH产率先升高后降低,降低的可能原因是___________ 。
③下列措施有利于提高CO2转化为CH3OH的平衡转化率的有___________ 。
A.增大体系压强
B.提高CO2和H2的投料比
C.体积和投料比不变,提高反应物浓度
(2)利用CH4与O2在催化剂的作用下合成甲醇。主反应:CH4(g)+
 O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性=
O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性= )如图丙所示:
)如图丙所示:___________
②主反应的相对压力平衡常数 =
=___________ 。(用含P和p0的计算式表示。 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
(1)利用CO2和H2合成甲醇,在催化剂Cu/ZnO作用下可发生如下两个平行反应。
反应I:CO2(g)+3H2(g)→CH3OH(g)+H2O(g)
反应II:CO2(g)+H2(g)→CO(g)+H2O(g);
温度对CO2转化率及甲醇和CO产率的影响如图乙所示。
②由图可知,温度升高CH3OH产率先升高后降低,降低的可能原因是
③下列措施有利于提高CO2转化为CH3OH的平衡转化率的有
A.增大体系压强
B.提高CO2和H2的投料比
C.体积和投料比不变,提高反应物浓度
(2)利用CH4与O2在催化剂的作用下合成甲醇。主反应:CH4(g)+

 O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性=
O2(g)→CH3OH(g),副反应:CH4(g)+2O2(g)→CO2(g)+2H2O(g)。在温度为T℃、压强为PKPa条件下,向容器中充入2molCH4、1molO2和6molH2O,充分反应达平衡时CH4的转化率为50%,产物的选择性(如甲醇的选择性= )如图丙所示:
)如图丙所示:
②主反应的相对压力平衡常数
 =
= 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以p0)
您最近一年使用:0次
解题方法
6 . 利用γ-丁内酯 制备1,4-丁二醇
制备1,4-丁二醇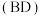 ,反应过程中伴有生成四氢呋喃
,反应过程中伴有生成四氢呋喃 和1-丁醇
和1-丁醇 的副反应,涉及反应如下:
的副反应,涉及反应如下: 氛围下进行,故
氛围下进行,故 压强近似等于总压。回答下列问题:
压强近似等于总压。回答下列问题:
(1)以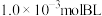 或
或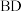 为初始原料,在
为初始原料,在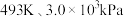 的高压
的高压 氛围下,分别在恒压容器中进行反应。达平衡时,以
氛围下,分别在恒压容器中进行反应。达平衡时,以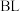 为原料,体系向环境放热
为原料,体系向环境放热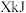 ,转化率为α;以
,转化率为α;以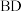 为原料,体系从环境吸热
为原料,体系从环境吸热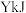 ,转化率为
,转化率为 。忽略副反应,反应Ⅰ焓变
。忽略副反应,反应Ⅰ焓变
_______  与
与 的数学关系为
的数学关系为_______ 。
(2)初始条件同上。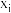 表示某物种i的物质的量与除
表示某物种i的物质的量与除 外其它各物种总物质的量之比,
外其它各物种总物质的量之比,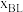 和
和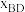 随时间t变化关系如图1所示。实验测得
随时间t变化关系如图1所示。实验测得 ,则图中表示初始反应物为
,则图中表示初始反应物为_______ (填“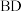 ”或“
”或“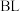 ”)时的变化关系;反应Ⅰ平衡常数
”)时的变化关系;反应Ⅰ平衡常数
_______  (保留两位有效数字)。以
(保留两位有效数字)。以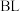 为原料时,
为原料时, 时刻
时刻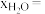
_______ , 产率=
产率=_______ (保留两位有效数字)。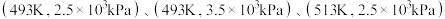 三种条件下,以
三种条件下,以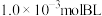 为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压
为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压 氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件
氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件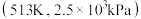 的是
的是_______ (填代号);与曲线b相比,曲线c达到平衡所需时间更长,原因是_______ 。
 制备1,4-丁二醇
制备1,4-丁二醇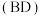 ,反应过程中伴有生成四氢呋喃
,反应过程中伴有生成四氢呋喃 和1-丁醇
和1-丁醇 的副反应,涉及反应如下:
的副反应,涉及反应如下:
 氛围下进行,故
氛围下进行,故 压强近似等于总压。回答下列问题:
压强近似等于总压。回答下列问题:(1)以
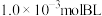 或
或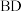 为初始原料,在
为初始原料,在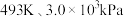 的高压
的高压 氛围下,分别在恒压容器中进行反应。达平衡时,以
氛围下,分别在恒压容器中进行反应。达平衡时,以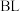 为原料,体系向环境放热
为原料,体系向环境放热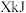 ,转化率为α;以
,转化率为α;以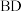 为原料,体系从环境吸热
为原料,体系从环境吸热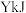 ,转化率为
,转化率为 。忽略副反应,反应Ⅰ焓变
。忽略副反应,反应Ⅰ焓变
 与
与 的数学关系为
的数学关系为(2)初始条件同上。
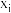 表示某物种i的物质的量与除
表示某物种i的物质的量与除 外其它各物种总物质的量之比,
外其它各物种总物质的量之比,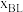 和
和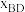 随时间t变化关系如图1所示。实验测得
随时间t变化关系如图1所示。实验测得 ,则图中表示初始反应物为
,则图中表示初始反应物为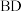 ”或“
”或“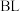 ”)时的变化关系;反应Ⅰ平衡常数
”)时的变化关系;反应Ⅰ平衡常数
 (保留两位有效数字)。以
(保留两位有效数字)。以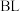 为原料时,
为原料时, 时刻
时刻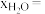
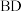 产率=
产率=
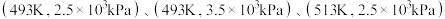 三种条件下,以
三种条件下,以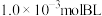 为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压
为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压 氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件
氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件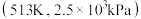 的是
的是
您最近一年使用:0次
解题方法
7 . 2023年9月23日第19届亚运会在我国杭州正式开幕。开幕式主火炬首次使用了零碳甲醇 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应 ;
;
反应ii: 。
。
(1)反应体系中存在反应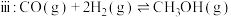 ,则
,则
____________  。
。
(2)将 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为____________ 。(计算结果保留三位有效数字)。
(2) 轴上
轴上 点的数值比
点的数值比 点
点____________ (填“大”或“小”)。
(3)在不同压强下,按照 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和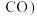 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: 由大到小的顺序为
由大到小的顺序为____________ 。
②曲线____________ (填“ ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。
③在 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
____________ (填含 的表达式)。
的表达式)。
(4)光催化 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
①光催化原理与电解原理类似,写出高能导带的电极反应式:____________ 。
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成____________ (填写微粒名称)参与 的还原再生。
的还原再生。
 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应
 ;
;反应ii:
 。
。(1)反应体系中存在反应
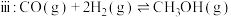 ,则
,则
 。
。(2)将
 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: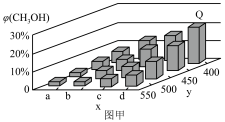
 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(2)
 轴上
轴上 点的数值比
点的数值比 点
点(3)在不同压强下,按照
 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和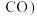 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: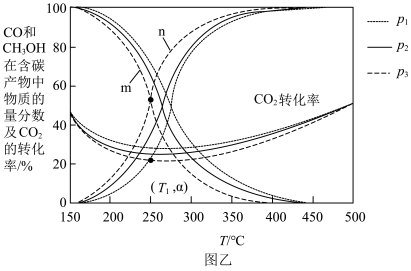
 由大到小的顺序为
由大到小的顺序为②曲线
 ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。③在
 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
 的表达式)。
的表达式)。(4)光催化
 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。①光催化原理与电解原理类似,写出高能导带的电极反应式:
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成
 的还原再生。
的还原再生。
您最近一年使用:0次
2024-04-16更新
|
376次组卷
|
2卷引用:黑龙江省部分学校2024届高三第二次模拟考试化学试题
解题方法
8 . 向100mL0.001mol⋅L-1A溶液中逐滴加入等浓度B溶液,反应为
 (忽略温度对
(忽略温度对 的影响)。下列说法错误的是
的影响)。下列说法错误的是


 (忽略温度对
(忽略温度对 的影响)。下列说法错误的是
的影响)。下列说法错误的是
A. |
B. |
C. 时,该反应平衡常数约为667L·mol-1 时,该反应平衡常数约为667L·mol-1 |
D. 时,100mL0.001mol⋅L-1的AB溶液达到平衡时,吸收热量Q>4.3J 时,100mL0.001mol⋅L-1的AB溶液达到平衡时,吸收热量Q>4.3J |
您最近一年使用:0次
名校
解题方法
9 . 甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。已知涉及的反应如下:
反应Ⅰ: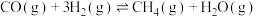 ∆H1<0
∆H1<0
反应Ⅱ: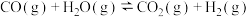 ∆H2<0
∆H2<0
在360℃时,在固定容积的容器中进行上述反应,平衡时CO和H2的转化率及CH4和 CO2的产率随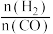 变化的情况如图所示。若按
变化的情况如图所示。若按  向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性=
向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性= 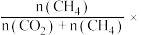 100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是
100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是

反应Ⅰ:
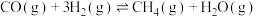 ∆H1<0
∆H1<0反应Ⅱ:
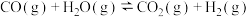 ∆H2<0
∆H2<0在360℃时,在固定容积的容器中进行上述反应,平衡时CO和H2的转化率及CH4和 CO2的产率随
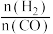 变化的情况如图所示。若按
变化的情况如图所示。若按  向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性=
向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性= 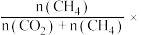 100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是
100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是
A.图中表示CO转化率变化的曲线是 b, 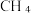 产率变化的曲线是c 产率变化的曲线是c |
B.点 C 通过改变温度达到点 A,则 A、B、C 三点温度由大到小为  |
C.若两个反应达到平衡时总压为  ,CO的平衡转化率为a,则 CH₄的选择性 ,CO的平衡转化率为a,则 CH₄的选择性 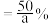 |
D.若两个反应达到平衡时总压为 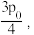 CO的平衡转化率为a,则反应Ⅰ的 CO的平衡转化率为a,则反应Ⅰ的  |
您最近一年使用:0次
名校
解题方法
10 . 利用可见光催化还原 ,将
,将 转化为增值化学原料(HCHO、HCOOH、
转化为增值化学原料(HCHO、HCOOH、 等),这被认为是一种可持续的
等),这被认为是一种可持续的 资源化有效途径。
资源化有效途径。
(1)已知几种物质的燃烧热(△H)如表所示:
已知:
 ,则
,则

______  。
。
(2)我国学者探究了BiIn合金催化剂电化学还原 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是______ 。

(3) 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:
ⅰ、

ⅱ、

ⅲ、

一定压强下,往某密闭容器中按投料比 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①下列说法正确的是______ 。
A.恒温恒压时充入氦气,反应ⅱ、ⅲ的平衡均逆向移动,反应ⅰ不移动
B.增大 的比值,
的比值, 的平衡转化率增大
的平衡转化率增大
C.图中X、Y分别代表CO、
D.体系中的 的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反
的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反
②在上图中画出反应达到平衡时, 随温度变化趋势图(只用画220℃以后)
随温度变化趋势图(只用画220℃以后)______ 。
③在一定温度下,向容积为2L的恒容密闭容器中充入1mo1 (g)和nmol
(g)和nmol (g)。仅发生反应ⅲ。实验测得
(g)。仅发生反应ⅲ。实验测得 的平衡分压与起始投料比[
的平衡分压与起始投料比[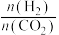 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
______  (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。

 ,将
,将 转化为增值化学原料(HCHO、HCOOH、
转化为增值化学原料(HCHO、HCOOH、 等),这被认为是一种可持续的
等),这被认为是一种可持续的 资源化有效途径。
资源化有效途径。(1)已知几种物质的燃烧热(△H)如表所示:
| 物质 | HCHO(g) |  (g) (g) |
燃烧热(△H)( ) ) | -570.8 | -285.8 |

 ,则
,则

 。
。(2)我国学者探究了BiIn合金催化剂电化学还原
 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
(3)
 催化加氢制
催化加氢制 的反应体系中,发生的主要反应有:
的反应体系中,发生的主要反应有:ⅰ、


ⅱ、


ⅲ、


一定压强下,往某密闭容器中按投料比
 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
①下列说法正确的是
A.恒温恒压时充入氦气,反应ⅱ、ⅲ的平衡均逆向移动,反应ⅰ不移动
B.增大
 的比值,
的比值, 的平衡转化率增大
的平衡转化率增大C.图中X、Y分别代表CO、

D.体系中的
 的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反
的物质的量分数随温度变化不大,原因是温度变化,反应ⅰ、ⅲ的平衡移动方向相反②在上图中画出反应达到平衡时,
 随温度变化趋势图(只用画220℃以后)
随温度变化趋势图(只用画220℃以后)③在一定温度下,向容积为2L的恒容密闭容器中充入1mo1
 (g)和nmol
(g)和nmol (g)。仅发生反应ⅲ。实验测得
(g)。仅发生反应ⅲ。实验测得 的平衡分压与起始投料比[
的平衡分压与起始投料比[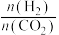 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数
 (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
您最近一年使用:0次



