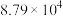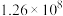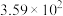2024高三·全国·专题练习
1 . 甲醇脱氢法制HCOOCH3的工艺过程涉及如下反应:
反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g);ΔH1=+135.4kJ·mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g);ΔH2=+106.0kJ·mol-1 ×100%。下列说法正确的是
×100%。下列说法正确的是
反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g);ΔH1=+135.4kJ·mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g);ΔH2=+106.0kJ·mol-1
 ×100%。下列说法正确的是
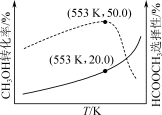
×100%。下列说法正确的是| A.HCOOCH3(g)=2CO(g)+2H2(g)的ΔH=-76.6kJ·mol-1 |
| B.虚线代表的是CH3OH的转化率 |
| C.553K时,HCOOCH3的产量为0.05mol |
| D.低于553K时,温度越高,生成的CO越多;高于553K时,温度越高,生成的HCOOCH3越多 |
您最近半年使用:0次
2 . 处理NO、 是减少空气污染的重要途径。
是减少空气污染的重要途径。
已知:
①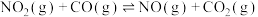
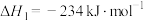
②
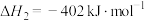
③

④
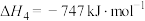
回答下列问题:
(1)
________  。
。
(2)已知反应①的正反应活化能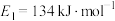 ,则其逆反应活化能
,则其逆反应活化能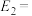
________  。
。
(3)向密闭反应器中按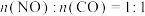 投料,发生反应④。相同时间内,不同温度下,测得NO的转化率与催化剂Cat1,Cat2的关系如图1所示。
投料,发生反应④。相同时间内,不同温度下,测得NO的转化率与催化剂Cat1,Cat2的关系如图1所示。________ (填“Cat1”或“Cat2”)。
②Cat1作用下,400℃时b点___________ (填“达到”或“未达到”)平衡状态,判断依据是_______________________ 。
③T>400℃,b→c的可能原因是________________ 。
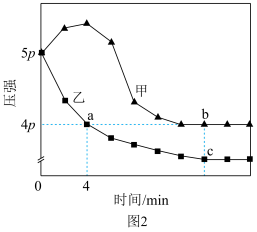
(4)在甲、乙均为1L的恒容密闭容器中均充入2mol NO和2mol CO,在恒温和绝热两种条件下仅发生反应④,测得压强变化如图2所示。________ (填“恒温”或“绝热”)。
②乙容器中0~4min内NO的平均反应速率为__________  。a点放出的热量为
。a点放出的热量为__________ kJ。
 是减少空气污染的重要途径。
是减少空气污染的重要途径。已知:
①
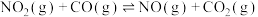
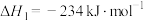
②

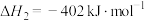
③


④

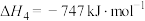
回答下列问题:
(1)

 。
。(2)已知反应①的正反应活化能
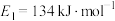 ,则其逆反应活化能
,则其逆反应活化能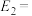
 。
。(3)向密闭反应器中按
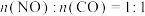 投料,发生反应④。相同时间内,不同温度下,测得NO的转化率与催化剂Cat1,Cat2的关系如图1所示。
投料,发生反应④。相同时间内,不同温度下,测得NO的转化率与催化剂Cat1,Cat2的关系如图1所示。 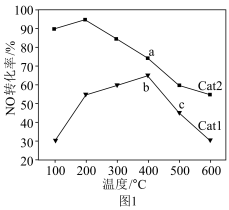
②Cat1作用下,400℃时b点
③T>400℃,b→c的可能原因是
(4)在甲、乙均为1L的恒容密闭容器中均充入2mol NO和2mol CO,在恒温和绝热两种条件下仅发生反应④,测得压强变化如图2所示。
②乙容器中0~4min内NO的平均反应速率为
 。a点放出的热量为
。a点放出的热量为
您最近半年使用:0次
3 . 在 ℃,
℃,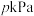 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol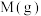 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时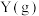 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
 ℃,
℃,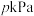 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol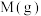 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时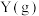 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.随着 的增大, 的增大,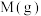 的转化率逐渐增大 的转化率逐渐增大 |
B.e点: |
C.a点时,该反应的平衡常数为 |
D.a点,平衡后再投入1mol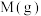 和1mol 和1mol ,达到新平衡时, ,达到新平衡时,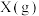 的产率增大 的产率增大 |
您最近半年使用:0次
解题方法
4 . 燃煤脱硫是科研工作者的重要研究课题,石灰法是其中之一,相关反应如下:
请回答下列问题:
(1) 、
、 、
、 之间的关系为
之间的关系为
___________ (用含 、
、 的代数式表示);图中能表示
的代数式表示);图中能表示 随
随 变化的直线为
变化的直线为___________ (填“Ⅰ”或“Ⅱ”)。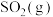 、
、 ,并加入足量的
,并加入足量的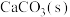 ,总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下
,总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下 的平衡转化率
的平衡转化率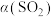 与混合气体的投料比
与混合气体的投料比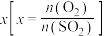 之间的关系如图所示。
之间的关系如图所示。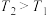 ,理由是
,理由是___________ 。
②在 温度下,该反应的平衡常数
温度下,该反应的平衡常数
___________  (用分数表示,
(用分数表示, 是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
③其他条件不变,若向M点反应体系中充入一定量的 (
( 不参与反应),则
不参与反应),则 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”),原因是___________ 。
| 相关反应 | 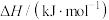 | 平衡常数( ) ) | |
| ⅰ | 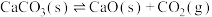 |  |  |
| ⅱ | 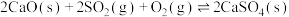 |  |  |
| ⅲ | 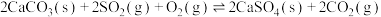 |  |  |
(1)
 、
、 、
、 之间的关系为
之间的关系为
 、
、 的代数式表示);图中能表示
的代数式表示);图中能表示 随
随 变化的直线为
变化的直线为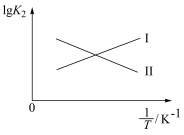
 、
、 ,并加入足量的
,并加入足量的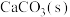 ,总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下
,总压强保持8MPa不变的条件下仅发生上述反应ⅲ,测得在两种温度下 的平衡转化率
的平衡转化率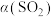 与混合气体的投料比
与混合气体的投料比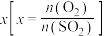 之间的关系如图所示。
之间的关系如图所示。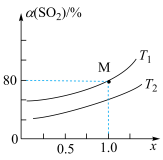
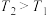 ,理由是
,理由是②在
 温度下,该反应的平衡常数
温度下,该反应的平衡常数
 (用分数表示,
(用分数表示, 是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。③其他条件不变,若向M点反应体系中充入一定量的
 (
( 不参与反应),则
不参与反应),则 的平衡转化率
的平衡转化率
您最近半年使用:0次
名校
解题方法
5 . 氙的氟化物被广泛用作刻蚀剂、氧化剂和氟化剂,稀有气体Xe和 混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
反应ⅰ: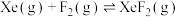

反应ⅱ: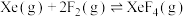

反应ⅲ: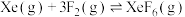

(1)关于上述反应,下列有关说法正确的是______ (填标号)。
A.当体系总压不再改变时,反应达到平衡
B.当Xe与 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于Xe
C.达到平衡后将 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
(2)升高温度,平衡
______ (填“正向移动”“逆向移动”或“不移动”),理由是______ (根据数据计算说明)。
(3)已知: 选择性是指生成
选择性是指生成 所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的
所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的 ,初始压强为
,初始压强为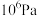 ,测得在相同时间内,上述反应Xe的转化率和
,测得在相同时间内,上述反应Xe的转化率和 的选择性与温度的关系如图1所示,则制取
的选择性与温度的关系如图1所示,则制取 的最适宜温度为
的最适宜温度为______ ;当超过1000℃, 选择性随着温度升高而降低的可能原因是
选择性随着温度升高而降低的可能原因是______ 。 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为 ,Xe和F的最短距离为b nm。
,Xe和F的最短距离为b nm。______ 。
②该晶体的密度为______  。
。
 混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):反应ⅰ:
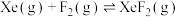

反应ⅱ:
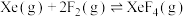

反应ⅲ:
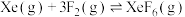

温度/℃ |
|
|
250 |
|
|
400 |
|
|
(1)关于上述反应,下列有关说法正确的是
A.当体系总压不再改变时,反应达到平衡
B.当Xe与
 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于XeC.达到平衡后将
 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动(2)升高温度,平衡

(3)已知:
 选择性是指生成
选择性是指生成 所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的
所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的 ,初始压强为
,初始压强为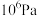 ,测得在相同时间内,上述反应Xe的转化率和
,测得在相同时间内,上述反应Xe的转化率和 的选择性与温度的关系如图1所示,则制取
的选择性与温度的关系如图1所示,则制取 的最适宜温度为
的最适宜温度为 选择性随着温度升高而降低的可能原因是
选择性随着温度升高而降低的可能原因是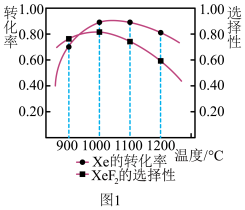
 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为 ,Xe和F的最短距离为b nm。
,Xe和F的最短距离为b nm。
②该晶体的密度为
 。
。
您最近半年使用:0次
6 . 工业上常用 和
和 为原料合成甲醇
为原料合成甲醇 ,过程中发生如下反应:
,过程中发生如下反应: 。在
。在 温度下,向
温度下,向 刚性容器中充入
刚性容器中充入 和一定物质的量的
和一定物质的量的 ,随着充入
,随着充入 的物质的量的不同,平衡时容器中
的物质的量的不同,平衡时容器中 的体积分数变化曲线如图所示。下列说法错误的是
的体积分数变化曲线如图所示。下列说法错误的是
 和
和 为原料合成甲醇
为原料合成甲醇 ,过程中发生如下反应:
,过程中发生如下反应: 。在
。在 温度下,向
温度下,向 刚性容器中充入
刚性容器中充入 和一定物质的量的
和一定物质的量的 ,随着充入
,随着充入 的物质的量的不同,平衡时容器中
的物质的量的不同,平衡时容器中 的体积分数变化曲线如图所示。下列说法错误的是
的体积分数变化曲线如图所示。下列说法错误的是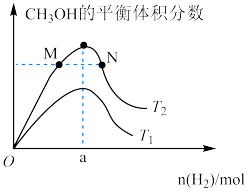
A. | B. |
C.平衡常数 | D.该反应在高温高压条件下自发进行 |
您最近半年使用:0次
名校
7 . 一定条件下可合成乙烯:6H2(g)+2CO2(g) ⇌CH2=CH2 (g)+4H2O(g) 已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是
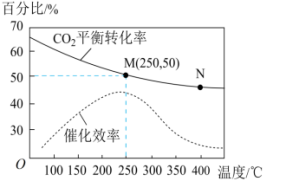
| A.温度不变,若增大压强,ν正增加、ν逆减小 |
| B.升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 |
| C.温度不变,若恒压下向平衡体系中充入惰性气体,平衡不移动 |
| D.若投料比n(H2):n(CO2)=3:1,则图中 M点乙烯的体积分数为7.7% |
您最近半年使用:0次
名校
解题方法
8 . 亚硝酰氯(NOCl)常用于合成洗涤剂、触媒,也可用作有机合成中间体。可通过反应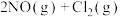
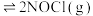 获得。
获得。
1.亚硝酰氯参与大气平流层和对流层化学,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①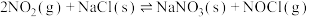

②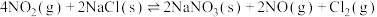

③

则
___________ (用 和
和 表示)。
表示)。
2.已知几种化学键的键能数据如表所示(NO的结构式:N≡O,亚硝酰氯的结构式:Cl—N=O):
则反应 的
的
___________  (用含a的代数式表示)。
(用含a的代数式表示)。
按投料比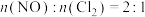 把NO和
把NO和 加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:
加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:
___________ 0(填“>”“<”或“=”),理由是___________ 。
4.能标志该反应达到化学平衡状态的是___________。
5.计算图中M点处容器内NO的体积分数为___________ 。
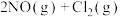
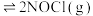 获得。
获得。1.亚硝酰氯参与大气平流层和对流层化学,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①
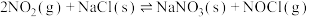

②
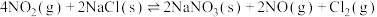

③


则

 和
和 表示)。
表示)。2.已知几种化学键的键能数据如表所示(NO的结构式:N≡O,亚硝酰氯的结构式:Cl—N=O):
| 化学键 | N≡O | Cl—Cl | Cl—N | N=O |
键能/ | 630 | 243 | a | 607 |
 的
的
 (用含a的代数式表示)。
(用含a的代数式表示)。按投料比
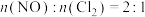 把NO和
把NO和 加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:
加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:

4.能标志该反应达到化学平衡状态的是___________。
| A.容器内总压强不再变化 | B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 | D.NO与NOCl的体积分数相等 |
您最近半年使用:0次
9 . 甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: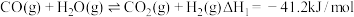 ,
, ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是__________________________ 。
在体积可变的恒压密闭容器中投入 和
和 ,不同条件下发生上述反应。实验测得平衡时
,不同条件下发生上述反应。实验测得平衡时 的物质的量
的物质的量 随温度
随温度 、压强
、压强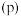 的变化如图1所示。
的变化如图1所示。____________ P2(填“<”或“>”)
(3)M点对应的平衡混合气体的体积为 ,则
,则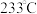 时,该反应的平衡常数
时,该反应的平衡常数
__________ , 的转化率为
的转化率为__________________ (保留1位小数)。
(4)工业上可利用甲醇茾基化法进一步制取甲酸甲酯: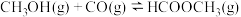 。在容积不变的密闭容器中,投入等物质的量的
。在容积不变的密闭容器中,投入等物质的量的 和
和 ,相同时间内
,相同时间内 的转化率随温度变化如图2所示(不考虑其他副反应)。
的转化率随温度变化如图2所示(不考虑其他副反应)。______________ 。
②该反应是______________ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由___________________ 。
(1)已知一定条件下,发生反应:
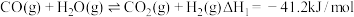 ,
, ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是在体积可变的恒压密闭容器中投入
 和
和 ,不同条件下发生上述反应。实验测得平衡时
,不同条件下发生上述反应。实验测得平衡时 的物质的量
的物质的量 随温度
随温度 、压强
、压强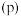 的变化如图1所示。
的变化如图1所示。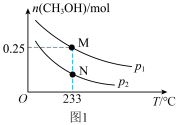
(3)M点对应的平衡混合气体的体积为
 ,则
,则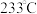 时,该反应的平衡常数
时,该反应的平衡常数
 的转化率为
的转化率为(4)工业上可利用甲醇茾基化法进一步制取甲酸甲酯:
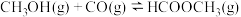 。在容积不变的密闭容器中,投入等物质的量的
。在容积不变的密闭容器中,投入等物质的量的 和
和 ,相同时间内
,相同时间内 的转化率随温度变化如图2所示(不考虑其他副反应)。
的转化率随温度变化如图2所示(不考虑其他副反应)。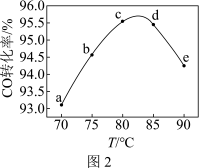
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由
您最近半年使用:0次
10 . 恒容密闭容器中充入X,在催化剂作用下发生反应: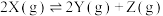 ,起始压强为p kPa,反应时间为t s,测得X的转化率随温度的变化如图中实线所示(虚线表示平衡转化率)。下列说法正确的是
,起始压强为p kPa,反应时间为t s,测得X的转化率随温度的变化如图中实线所示(虚线表示平衡转化率)。下列说法正确的是
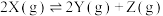 ,起始压强为p kPa,反应时间为t s,测得X的转化率随温度的变化如图中实线所示(虚线表示平衡转化率)。下列说法正确的是
,起始压强为p kPa,反应时间为t s,测得X的转化率随温度的变化如图中实线所示(虚线表示平衡转化率)。下列说法正确的是
A.该反应的 |
| B.催化剂可降低该反应的焓变,提高平衡转化率 |
| C.增大起始压强,X的平衡转化率增大 |
D.800℃时,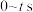 内化学反应速率 内化学反应速率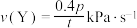 |
您最近半年使用:0次