解题方法
1 . 含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。回答下列问题:
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O。
=CaSO3↓+2NH3·H2O。
(1)已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=___ (用含a、b的代数式表示)。
II.水煤气还原法CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH
已知:i.2CO(g)+SO2(g)⇌S(l)+2CO2(g) ΔH1=-37.0kJ·mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g) ΔH2=+45.4kJ·mol-1
(2)①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=_______ ;
②若该反应在恒温、恒容体系中进行,达到平衡的标志_______ ;
A.氢氧键的断裂速率等于氢氢键的生成速率
B.混合气体的密度保持不变
C.混合气体的总压强保持不变
D.H2O(g)与H2(g)的体积比保持不变
③反应ⅱ的正反应的活化能E_______ (填“>”“<”或“=”)ΔH2。
(3)在一定压强下,发生反应ⅱ。平衡时,α(SO2)(二氧化硫的转化率)与原料气投料比n(SO2)/n(H2)和温度(T)的关系如图所示。
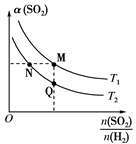
则转化率α(H2):N____ Q,逆反应速率:M____ Q(填“>”“<”或“=”)。
(4)T℃,向1L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应ⅰ和反应ⅱ。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。该温度下,反应ⅱ的平衡常数K=_______ 。
I.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2
 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O。
=CaSO3↓+2NH3·H2O。(1)已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=
II.水煤气还原法CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH
已知:i.2CO(g)+SO2(g)⇌S(l)+2CO2(g) ΔH1=-37.0kJ·mol-1
ii.2H2(g)+SO2(g)⇌S(l)+2H2O(g) ΔH2=+45.4kJ·mol-1
(2)①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=
②若该反应在恒温、恒容体系中进行,达到平衡的标志
A.氢氧键的断裂速率等于氢氢键的生成速率
B.混合气体的密度保持不变
C.混合气体的总压强保持不变
D.H2O(g)与H2(g)的体积比保持不变
③反应ⅱ的正反应的活化能E
(3)在一定压强下,发生反应ⅱ。平衡时,α(SO2)(二氧化硫的转化率)与原料气投料比n(SO2)/n(H2)和温度(T)的关系如图所示。

则转化率α(H2):N
(4)T℃,向1L恒容密闭容器中充入2molCO(g)、2molSO2(g)和2molH2(g),发生反应ⅰ和反应ⅱ。5min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6mol、1.8mol。该温度下,反应ⅱ的平衡常数K=
您最近一年使用:0次
名校
2 . 在体积可变的恒压密闭容器中,一定量的CO2与足量碳发生反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图。下列说法正确的是
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图。下列说法正确的是

 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图。下列说法正确的是
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图。下列说法正确的是
| A.升高温度,反应速率增大,K减小 |
| B.550 ℃时,在平衡体系中充入惰性气体,平衡不移动 |
| C.650 ℃时,CO2的平衡转化率为25.0% |
| D.T1℃时,在平衡体系中充入等体积的CO2和CO,平衡将向左移动 |
您最近一年使用:0次
2021-07-20更新
|
438次组卷
|
2卷引用:重庆市第十一中学校2021届高三下学期4月二诊化学试题
名校
解题方法
3 . 血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度α(吸附 的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压
的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压 密切相关。请回答下列问题:
密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附 、
、 ,相关反应的热化学方程式及平衡常数如下:
,相关反应的热化学方程式及平衡常数如下:
I.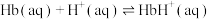


II.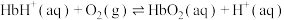


III.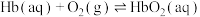



___________ (用 、
、 表示),
表示),
___________ (用 、
、 表示)。
表示)。
(2)Hb与氧气的结合能力受到 的影响,相关反应如下:
的影响,相关反应如下: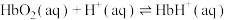
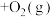 。37℃,pH分别为7.2、7.4、7.6时氧气分压
。37℃,pH分别为7.2、7.4、7.6时氧气分压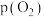 与达到平衡时Hb与氧气的结合度α的关系如图1所示,pH=7.6时对应的曲线为
与达到平衡时Hb与氧气的结合度α的关系如图1所示,pH=7.6时对应的曲线为___________ (填“A”或“B”)。
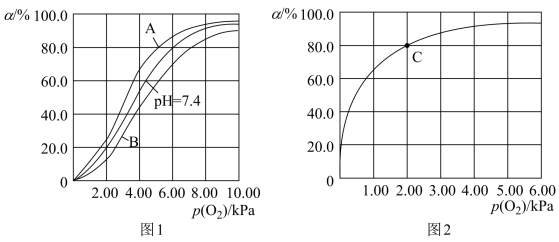
(3)Mb与氧气结合的反应如下: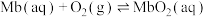
 ,37℃,氧气分压
,37℃,氧气分压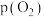 与达平衡时Mb与氧气的结合度α的关系如图2所示。
与达平衡时Mb与氧气的结合度α的关系如图2所示。
①已知Mb与氧气结合的反应的平衡常数表达式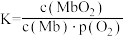 ,计算37℃时K=
,计算37℃时K=___________  。
。
②人正常呼吸时,体温约为37℃,氧气分压约为20.00kPa,计算此时Mb与氧气的最大结合度为___________ (结果精确到0.1%)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的
___________ (填“>”或“<”)0。
④已知37℃时,上述反应的正反应速率 ,逆反应速率
,逆反应速率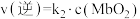 ,若
,若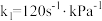 ,则
,则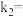
___________ 。37℃时,图2中C点时,
___________ 。
 的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压
的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压 密切相关。请回答下列问题:
密切相关。请回答下列问题:(1)人体中的血红蛋白(Hb)能吸附
 、
、 ,相关反应的热化学方程式及平衡常数如下:
,相关反应的热化学方程式及平衡常数如下:I.
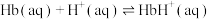


II.
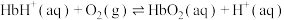


III.
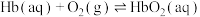



 、
、 表示),
表示),
 、
、 表示)。
表示)。(2)Hb与氧气的结合能力受到
 的影响,相关反应如下:
的影响,相关反应如下: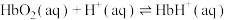
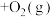 。37℃,pH分别为7.2、7.4、7.6时氧气分压
。37℃,pH分别为7.2、7.4、7.6时氧气分压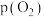 与达到平衡时Hb与氧气的结合度α的关系如图1所示,pH=7.6时对应的曲线为
与达到平衡时Hb与氧气的结合度α的关系如图1所示,pH=7.6时对应的曲线为
(3)Mb与氧气结合的反应如下:
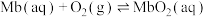
 ,37℃,氧气分压
,37℃,氧气分压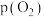 与达平衡时Mb与氧气的结合度α的关系如图2所示。
与达平衡时Mb与氧气的结合度α的关系如图2所示。①已知Mb与氧气结合的反应的平衡常数表达式
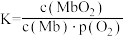 ,计算37℃时K=
,计算37℃时K= 。
。②人正常呼吸时,体温约为37℃,氧气分压约为20.00kPa,计算此时Mb与氧气的最大结合度为
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的

④已知37℃时,上述反应的正反应速率
 ,逆反应速率
,逆反应速率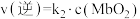 ,若
,若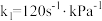 ,则
,则

您最近一年使用:0次
2021-11-23更新
|
259次组卷
|
7卷引用:湘赣皖十五校(长郡中学、南昌二中等)2020届高三下学期第一次联考模拟化学试题
解题方法
4 . 工业制硫酸的反应之一为:2SO2(g)+O2(g) 2SO3(g),在2 L恒温恒容密闭容器中投入2 mol SO2和1mol O2在一定条件下充分反应,下图是SO2和SO3随时间的变化曲线。
2SO3(g),在2 L恒温恒容密闭容器中投入2 mol SO2和1mol O2在一定条件下充分反应,下图是SO2和SO3随时间的变化曲线。

(1)前10min SO3的平均反应速率为___________ ;平衡时,SO2转化率为___________ 。
(2)下列叙述不能判断该反应达到平衡状态的是___________ ;
①容器中压强不再改变;
②容器中气体密度不再改变;
③SO3的质量不再改变;
④O2的物质的量浓度不再改变;
⑤容器内气体原子总数不再发生变化;
(3)以下操作会引起化学反应速率变快的是__ 。
A.向容器中通入氦气
B.升高温度
C.扩大容器的体积
D.向容器中通入O2
E.使用正催化剂
(4)反应达平衡时,体系的压强与开始时的压强之比为____ ;容器内混合气体的平均相对分子质量和起始投料时相比____ (填“增大”“减小”或“不变”)。
 2SO3(g),在2 L恒温恒容密闭容器中投入2 mol SO2和1mol O2在一定条件下充分反应,下图是SO2和SO3随时间的变化曲线。
2SO3(g),在2 L恒温恒容密闭容器中投入2 mol SO2和1mol O2在一定条件下充分反应,下图是SO2和SO3随时间的变化曲线。
(1)前10min SO3的平均反应速率为
(2)下列叙述不能判断该反应达到平衡状态的是
①容器中压强不再改变;
②容器中气体密度不再改变;
③SO3的质量不再改变;
④O2的物质的量浓度不再改变;
⑤容器内气体原子总数不再发生变化;
(3)以下操作会引起化学反应速率变快的是
A.向容器中通入氦气
B.升高温度
C.扩大容器的体积
D.向容器中通入O2
E.使用正催化剂
(4)反应达平衡时,体系的压强与开始时的压强之比为
您最近一年使用:0次
名校
5 . 一定条件下,合成氨反应:N2(g)+3H2(g)⇌ 2NH3(g)。图1表示在该反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物H2的物质的量对该反应平衡的影响。下列说法正确的是


| A.升高温度,正、逆反应速率均加快,N2的转化率增大 |
| B.由图2信息,10 min末该反应以N2表示的反应速率为v(N2)=0.015 mol·L-1·min-1 |
| C.由图2信息,从11 min起其他条件不变,增加N2的量,则n(N2)的变化曲线为d |
| D.图3中温度T1<T2,e、f、g三点所处的平衡状态中,反应物N2的转化率最高的是g点 |
您最近一年使用:0次
2021-07-16更新
|
677次组卷
|
10卷引用:河南省南阳市A类重点高中2020-2021学年高二下学期期末联考化学试题
河南省南阳市A类重点高中2020-2021学年高二下学期期末联考化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题江西省宜春市第九中学2021-2022学年高二上学期第一次月考化学试题福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题重庆市实验中学2021-2022学年上学期高二10月月考化学试题云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)北京市第二十中学2022-2023学年高二上学期12月月考化学试题安徽省桐城中学2021-2022学年高二下学期开学检测化学试题
解题方法
6 . 我国力争2060年前实现碳中和,将 转化为甲醇是实现碳中和的途径之一、原理为:
转化为甲醇是实现碳中和的途径之一、原理为: 。在一定温度下,体积为1L的密闭容器中,充入
。在一定温度下,体积为1L的密闭容器中,充入 和
和 ,测得
,测得 和
和 的浓度随时间变化如图所示。
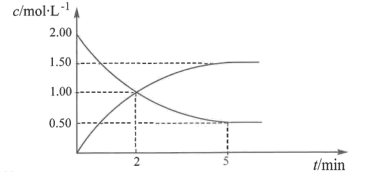
的浓度随时间变化如图所示。
回答下列问题:
(1)2min~5min的平均反应速率
_______ 。
(2)平衡时 的转化率为
的转化率为_______ %。
(3)2min时,
_______  (填“>”“<”“=”或“无法比较”)。
(填“>”“<”“=”或“无法比较”)。
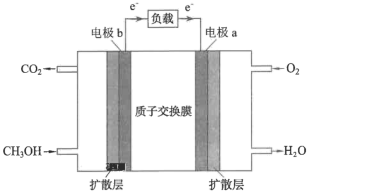
(4)下图为甲醇酸性燃料电池的构造示意图,根据原电池的工作原理,电极a是____ (填“正极”或“负极”),此电池工作时,负极的电极反应为___ 。
 转化为甲醇是实现碳中和的途径之一、原理为:
转化为甲醇是实现碳中和的途径之一、原理为: 。在一定温度下,体积为1L的密闭容器中,充入
。在一定温度下,体积为1L的密闭容器中,充入 和
和 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
回答下列问题:
(1)2min~5min的平均反应速率

(2)平衡时
 的转化率为
的转化率为(3)2min时,

 (填“>”“<”“=”或“无法比较”)。
(填“>”“<”“=”或“无法比较”)。(4)下图为甲醇酸性燃料电池的构造示意图,根据原电池的工作原理,电极a是

您最近一年使用:0次
名校
解题方法
7 . 分解 产生的
产生的 可用于还原
可用于还原 合成有机物,可实现资源的再利用。
合成有机物,可实现资源的再利用。
Ⅰ. 利用硫—碘循环来分解 制
制 ,其中主要涉及下列反应:①
,其中主要涉及下列反应:① ②
②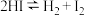 ③
③
(1)分析上述反应,下列判断正确的是_______ (填正确选项的字母编号)。
a. 反应①中氧化性: b. 循环过程中需不断补充
b. 循环过程中需不断补充
c. 反应③在常温下极易发生 d. 、
、 是该实验的最终目标产物
是该实验的最终目标产物
(2)一定温度下,向 密闭容器中加入
密闭容器中加入 ,反应生成
,反应生成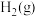 与
与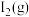 。
。

① 物质的量随时间的变化如图所示。
物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率
_______ 。
②下列事实能说明该反应达到平衡状态的是_______ (填正确选项的字母编号)。
a.
b. 混合气体的密度不再改变
c. 的浓度不再改变
的浓度不再改变
d. 容器内气体压强不再改变
③ 的平衡转化率为
的平衡转化率为_______ 。
④该温度下, 的平衡常数
的平衡常数
_______ 。
Ⅱ. 用 还原
还原 可以在一定条件下合成
可以在一定条件下合成 (不考虑副反应):
(不考虑副反应):
 。恒压下,
。恒压下, 和
和 的起始物质的量比为
的起始物质的量比为 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。
。

(1)甲醇平衡产率随温度升高而降低的原因是_______ 。
(2) 点甲醇产率高于
点甲醇产率高于 点的原因为
点的原因为_______ 。
(3)根据上图,在此条件下采用该分子筛膜时的最佳反应温度是_______ ℃。
 产生的
产生的 可用于还原
可用于还原 合成有机物,可实现资源的再利用。
合成有机物,可实现资源的再利用。Ⅰ. 利用硫—碘循环来分解
 制
制 ,其中主要涉及下列反应:①
,其中主要涉及下列反应:① ②
②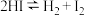 ③
③
(1)分析上述反应,下列判断正确的是
a. 反应①中氧化性:
 b. 循环过程中需不断补充
b. 循环过程中需不断补充
c. 反应③在常温下极易发生 d.
 、
、 是该实验的最终目标产物
是该实验的最终目标产物(2)一定温度下,向
 密闭容器中加入
密闭容器中加入 ,反应生成
,反应生成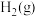 与
与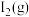 。
。
①
 物质的量随时间的变化如图所示。
物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率
②下列事实能说明该反应达到平衡状态的是
a.

b. 混合气体的密度不再改变
c.
 的浓度不再改变
的浓度不再改变d. 容器内气体压强不再改变
③
 的平衡转化率为
的平衡转化率为④该温度下,
 的平衡常数
的平衡常数
Ⅱ. 用
 还原
还原 可以在一定条件下合成
可以在一定条件下合成 (不考虑副反应):
(不考虑副反应):
 。恒压下,
。恒压下, 和
和 的起始物质的量比为
的起始物质的量比为 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。
。
(1)甲醇平衡产率随温度升高而降低的原因是
(2)
 点甲醇产率高于
点甲醇产率高于 点的原因为
点的原因为(3)根据上图,在此条件下采用该分子筛膜时的最佳反应温度是
您最近一年使用:0次
2021-07-15更新
|
231次组卷
|
2卷引用:广西桂林市2020-2021学年高二下学期期末质量检测化学试题
名校
8 . Ⅰ.在2020年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标。使利用 合成高价值化学品更突显其重要性。
合成高价值化学品更突显其重要性。
工业上可以利用 和
和 合成
合成 :
: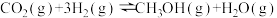 。在一个绝热恒容的密闭容器中置入1mol
。在一个绝热恒容的密闭容器中置入1mol 和3mol
和3mol ,当
,当___________  时,说明反应达到平衡状态。
时,说明反应达到平衡状态。
Ⅱ.利用 超干重整
超干重整 的催化转化如图所示:
的催化转化如图所示:

(1) 与
与 超干重整反应的化学方程式为
超干重整反应的化学方程式为___________ 。
(2)有关转化过程,下列说法正确的是___________ (填序号)
a.过程Ⅰ中 未参与反应
未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转换②中CaO消耗过程中的 ,有利于反应正向进行
,有利于反应正向进行
d.转化③中Fe与 反应的物质的量之比为4∶3
反应的物质的量之比为4∶3
Ⅲ.在K℃下,分别将0.20mol 、0.40molClF充入2L和1L的两个刚性容器中,发生反应:
、0.40molClF充入2L和1L的两个刚性容器中,发生反应: 。实验测得
。实验测得 的体积分数随时间变化如图所示:
的体积分数随时间变化如图所示:

(1)针对 ,若仅从浓度而言,则
,若仅从浓度而言,则 、
、 、
、 、
、 大小顺序为
大小顺序为___________ 。
(2)反应进行到d点时,反应速率
___________  。
。
 合成高价值化学品更突显其重要性。
合成高价值化学品更突显其重要性。工业上可以利用
 和
和 合成
合成 :
: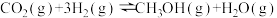 。在一个绝热恒容的密闭容器中置入1mol
。在一个绝热恒容的密闭容器中置入1mol 和3mol
和3mol ,当
,当 时,说明反应达到平衡状态。
时,说明反应达到平衡状态。Ⅱ.利用
 超干重整
超干重整 的催化转化如图所示:
的催化转化如图所示:
(1)
 与
与 超干重整反应的化学方程式为
超干重整反应的化学方程式为(2)有关转化过程,下列说法正确的是
a.过程Ⅰ中
 未参与反应
未参与反应b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转换②中CaO消耗过程中的
 ,有利于反应正向进行
,有利于反应正向进行d.转化③中Fe与
 反应的物质的量之比为4∶3
反应的物质的量之比为4∶3Ⅲ.在K℃下,分别将0.20mol
 、0.40molClF充入2L和1L的两个刚性容器中,发生反应:
、0.40molClF充入2L和1L的两个刚性容器中,发生反应: 。实验测得
。实验测得 的体积分数随时间变化如图所示:
的体积分数随时间变化如图所示:
(1)针对
 ,若仅从浓度而言,则
,若仅从浓度而言,则 、
、 、
、 、
、 大小顺序为
大小顺序为(2)反应进行到d点时,反应速率

 。
。
您最近一年使用:0次
2021-07-13更新
|
326次组卷
|
2卷引用:山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题
名校
解题方法
9 . 已知常温下两种难溶硫化物 、BS在水中的沉淀溶解平衡曲线如图所示。已知阴、阳离子浓度的单位为
、BS在水中的沉淀溶解平衡曲线如图所示。已知阴、阳离子浓度的单位为 ,下列说法不正确的是
,下列说法不正确的是
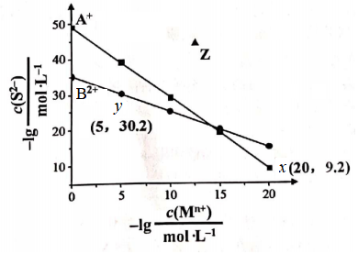
 、BS在水中的沉淀溶解平衡曲线如图所示。已知阴、阳离子浓度的单位为
、BS在水中的沉淀溶解平衡曲线如图所示。已知阴、阳离子浓度的单位为 ,下列说法不正确的是
,下列说法不正确的是
A.Z点为 的分散系:v(沉淀)<v(溶解) 的分散系:v(沉淀)<v(溶解) |
B.向含BS沉淀的过饱和溶液中加入一定量的 固体,Ksp(BS)不变 固体,Ksp(BS)不变 |
C.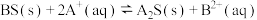 反应趋于完全 反应趋于完全 |
D. |
您最近一年使用:0次
2021-07-12更新
|
220次组卷
|
2卷引用:河南省驻马店市2020-2021学年高二下学期期末考试化学试题
解题方法
10 . 在容积为1L的恒容密闭容器中,充入 和
和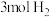 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的浓度随时间的变化如图所示。下列说法错误的是
的浓度随时间的变化如图所示。下列说法错误的是

 和
和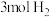 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的浓度随时间的变化如图所示。下列说法错误的是
的浓度随时间的变化如图所示。下列说法错误的是
A.0~9min内,用 表示的平均反应速率 表示的平均反应速率 |
| B.3min时正逆反应速率相等,反应刚好达到平衡 |
C.反应达到平衡后, |
D.9min时的 小于3min时的 小于3min时的 |
您最近一年使用:0次
2021-07-11更新
|
404次组卷
|
3卷引用:河南省焦作市普通高中2021-2022学年高二上学期开学联考化学试题
河南省焦作市普通高中2021-2022学年高二上学期开学联考化学试题(已下线)2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)课时1化学平衡状态随堂练习



