解题方法
1 . 顺-1,-2二甲基环丙烷(A)和反-1,-2二甲基环丙烷(B)可发生如下异构化反应如图所示,如下为在压强恒定为100kPa时,不同条件下进行该异构化反应(图中“○”表示A,“◇”表示B)的图象。下列说法正确的是




A.图①达平衡时,A的转化率 |
| B.四幅图中,图②的化学平衡常数K最大 |
| C.图③和图④的反应温度相同 |
| D.图④达平衡后,增大压强能提高B的物质的量分数 |
您最近一年使用:0次
2 . 回答下列问题
Ⅰ.一定条件下,在容积为5 L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。

(1)达到平衡后加压,C的含量_______ (填写“变大”、“变小”、“不变”)。
(2)该反应的反应速率v随时间t的关系如图乙所示。

①根据图乙判断,在t3时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______ 。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应: ,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。

(3)该反应的逆反应是_______ (填写“吸热反应”、“放热反应”)。
(4)N点H2的体积分数是_______ 。
(5)图丙中M点对应的平衡常数Kp=_______ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_______ 。
Ⅰ.一定条件下,在容积为5 L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。

(1)达到平衡后加压,C的含量
(2)该反应的反应速率v随时间t的关系如图乙所示。

①根据图乙判断,在t3时刻改变的外界条件是
②a、b、c对应的平衡状态中,A的转化率最大的是状态
Ⅱ.在密闭容器中充入一定量的H2S,发生反应:
 ,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是
(4)N点H2的体积分数是
(5)图丙中M点对应的平衡常数Kp=
(6)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
名校
解题方法
3 . 合成氨工业在国民生产中有重要意义,以下是关于合成氨的有关问题,请回答:
(1)2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。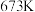 时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。
时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。

图中决速步骤的反应方程式为___________ ,该步反应的活化能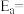
___________  。
。
(2)某小组进行工业合成氨N2(g)+3H2(g)⇌2NH3(g)ΔH<0的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2.实验①、②、③中c(N2)随时间(t)的变化如图所示。与实验①相比,实验②所改变的外界条件可能是___________ ,实验③所改变的外界条件可能为___________ 。

(3)400℃时,N2(g)+3H2(g)⇌2NH3(g)ΔH<0,K1=0.5,则反应2NH3(g)⇌N2(g)+3H2(g)的化学平衡常数K2=___________ ,若某时刻测得NH3、N2和H2物质的量浓度均 为1mol·L-1时,则该反应的 正
正___________  逆(填“<”、“>”或“=”)。
逆(填“<”、“>”或“=”)。
(4)某小组往一恒温恒压容器中充入9molN2和23molH2模拟合成氨的反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。

①温度T1、T2、T3中,最大的是___________ 。
②若体系在T2、60MPa下达到平衡如图,此时H2的平衡分压为___________ MPa,(分压=总压×物质的量分数),计算此时的平衡常数
___________ (MPa)-2.(用平衡分压代替平衡浓度计算,保留2位有效数字)
(1)2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。
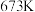 时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。
时,各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。
图中决速步骤的反应方程式为
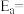
 。
。(2)某小组进行工业合成氨N2(g)+3H2(g)⇌2NH3(g)ΔH<0的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2.实验①、②、③中c(N2)随时间(t)的变化如图所示。与实验①相比,实验②所改变的外界条件可能是

(3)400℃时,N2(g)+3H2(g)⇌2NH3(g)ΔH<0,K1=0.5,则反应2NH3(g)⇌N2(g)+3H2(g)的化学平衡常数K2=
 正
正 逆(填“<”、“>”或“=”)。
逆(填“<”、“>”或“=”)。(4)某小组往一恒温恒压容器中充入9molN2和23molH2模拟合成氨的反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。

①温度T1、T2、T3中,最大的是
②若体系在T2、60MPa下达到平衡如图,此时H2的平衡分压为

您最近一年使用:0次
名校
解题方法
4 . 三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。对于反应2SiHCl3(g) ⇌SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是
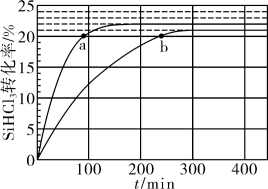

| A.343K时反应的平衡转化率为22% |
| B.a处反应速率大于b处 |
| C.在343K下,要缩短反应达到平衡的时间,可采取的措施有及时移去产物、改进催化剂 |
D.已知反应速率v=v正-v逆=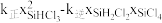 ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,则a处 ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,则a处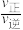 =1.3(保留1位小数) =1.3(保留1位小数) |
您最近一年使用:0次
2021-11-08更新
|
379次组卷
|
2卷引用:辽宁省沈阳市东北育才双语学校2021-2022学年高二上学期期中考试化学试题
名校
5 . 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。 可用于高效制取氢气,发生的反应为
可用于高效制取氢气,发生的反应为 。
。
(1)若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。

①图中曲线Y表示的物质是______ (填化学式)。
②C点时混合气体总物质的量为____ 。
③若起始时容器中 的浓度为1.0mol/L,则A点的平衡常数
的浓度为1.0mol/L,则A点的平衡常数
___________ 。
(2)若在两个等体积的恒容密闭容器中分别加入 、
、 ,测得不同温度下
,测得不同温度下 的平衡转化率如图所示。
的平衡转化率如图所示。

① 的裂解反应是
的裂解反应是____ (填“吸热”、“放热”)反应,图中代表加入 的曲线是
的曲线是____ (填代码)。
A.M点所在曲线 B.N、O点所在曲线
②M点、O点和N点的逆反应速率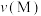 、
、 和
和 最慢的是
最慢的是____ 。
③M、O两点平衡常数的大小关系为K(M)____ K(O)(填“>”、“<”或“=”,下空同);M、N两点容器内的压强p(N) ____ 2p(M)。
 可用于高效制取氢气,发生的反应为
可用于高效制取氢气,发生的反应为 。
。(1)若起始时容器中只有
 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
①图中曲线Y表示的物质是
②C点时混合气体总物质的量为
③若起始时容器中
 的浓度为1.0mol/L,则A点的平衡常数
的浓度为1.0mol/L,则A点的平衡常数
(2)若在两个等体积的恒容密闭容器中分别加入
 、
、 ,测得不同温度下
,测得不同温度下 的平衡转化率如图所示。
的平衡转化率如图所示。
①
 的裂解反应是
的裂解反应是 的曲线是
的曲线是A.M点所在曲线 B.N、O点所在曲线
②M点、O点和N点的逆反应速率
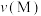 、
、 和
和 最慢的是
最慢的是③M、O两点平衡常数的大小关系为K(M)
您最近一年使用:0次
2021-11-08更新
|
105次组卷
|
2卷引用:广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题
名校
6 . 一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应: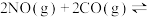
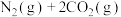 。各容器中起始物质的量浓度与反应温度如表所示:
。各容器中起始物质的量浓度与反应温度如表所示:
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是

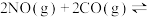
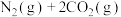 。各容器中起始物质的量浓度与反应温度如表所示:
。各容器中起始物质的量浓度与反应温度如表所示:| 容器 | 温度/℃ | 起始物质的量浓度/( ) ) | |||
| NO(g) | CO(g) | N2 | CO2 | ||
| 甲 | T1 | 0.10 | 0.10 | 0 | 0 |
| 乙 | T2 | 0 | 0 | 0.10 | 0.20 |
| 丙 | T2 | 0.10 | 0.10 | 0 | 0 |

A.该反应的正反应为吸热反应,平衡常数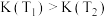 |
| B.乙容器中反应达到平衡时,N2的转化率小于40% |
| C.达到平衡时,乙容器中的压强一定大于甲容器的2倍 |
| D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时v(正)<v(逆) |
您最近一年使用:0次
7 . 我国力争在2060年前实现“碳中和”,综合利用CO2具有重要的意义。 、
、 条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应的热化学方程式为:CO2(g) + 3H2(g)
条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应的热化学方程式为:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH
(1)在一定温度下,2mol CO2与6mol H2置于2 L密闭容器中反应制得甲醇,2min末生成0.8mol CH3OH(g)。
① 用 的浓度变化表示2min内该反应的化学反应速率
的浓度变化表示2min内该反应的化学反应速率___________ 。
②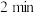 末,容器中H2的物质的量浓度
末,容器中H2的物质的量浓度___________ 。
(2)在实际生产中,测得合成塔中H2(g)及H2O(g)的物质的量随时间变化如图1所示,则图1中代表 的曲线是
的曲线是___________ (填“X”或“Y”), (正)与
(正)与 (逆)相等的点为
(逆)相等的点为___________ (填字母)。

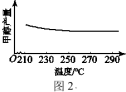
(3)研究温度对该反应的影响:
① 研究发现,在210~290℃,保持原料气中CO2和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图2所示,则该反应的ΔH___________ 0(填“>”“=”或“<”),依据是___________ 。
② 在温度为T1、T2时,平衡体系中CO2的体积分数随压强变化的曲线如图3所示。下列说法正确的是___________ 。
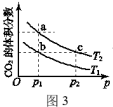
A.a、c两点的反应速率:a<c
B.a、b两点CO2的转化率:a>b
C.化学平衡常数:a=c<b
 、
、 条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应的热化学方程式为:CO2(g) + 3H2(g)
条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应的热化学方程式为:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH(1)在一定温度下,2mol CO2与6mol H2置于2 L密闭容器中反应制得甲醇,2min末生成0.8mol CH3OH(g)。
① 用
 的浓度变化表示2min内该反应的化学反应速率
的浓度变化表示2min内该反应的化学反应速率②
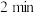 末,容器中H2的物质的量浓度
末,容器中H2的物质的量浓度(2)在实际生产中,测得合成塔中H2(g)及H2O(g)的物质的量随时间变化如图1所示,则图1中代表
 的曲线是
的曲线是 (正)与
(正)与 (逆)相等的点为
(逆)相等的点为
(3)研究温度对该反应的影响:
① 研究发现,在210~290℃,保持原料气中CO2和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图2所示,则该反应的ΔH

② 在温度为T1、T2时,平衡体系中CO2的体积分数随压强变化的曲线如图3所示。下列说法正确的是

A.a、c两点的反应速率:a<c
B.a、b两点CO2的转化率:a>b
C.化学平衡常数:a=c<b
您最近一年使用:0次
名校
解题方法
8 . 已知: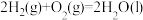
 ;
;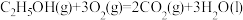
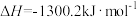 。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是
。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是

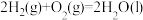
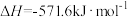 ;
;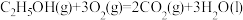
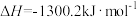 。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是
。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是
| A.由CO2(g)与H2(g)制取C2H5OH(g)的反应吸热 |
B.图中温度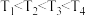 |
| C.图中投料比中的反应物X与Y分别指CO2与H2 |
| D.图中曲线最低温度、起始投料比为2时,H2平衡转化率为90% |
您最近一年使用:0次
2021-11-04更新
|
160次组卷
|
2卷引用:河北省九师联盟2021-2022学年高二上学期期中考试化学试题
名校
解题方法
9 . Ⅰ.CO2和H2在一定条件下可合成二甲醚(CH3OCH3):2CO2(g)+6H2(g) ⇌CH3OCH3(g)+3H2O(g) △H<0。温度为T时,在两个恒容密闭容器中进行上述反应,一段时间后测得的两个容器中有关物质的浓度及对正、逆反应速率关系的判断如表所示:
(1)容器I中的反应______________ (填”达到”或”未达到”)平衡状态。
(2)该反应在温度为T时的平衡常数K=___________ 。
(3)容器Ⅱ中反应向____________ (填”正”或”逆”)反应方向进行。
(4)从理论上分析,工业上合成二甲醚时,为提高H2的转化率,可采取的措施是___________ (任写三点)。
Ⅱ.在密闭容器中充入10molCO与20molH2合成CH3OH,反应为CO(g)+2H2(g) ⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。

(5)则M、N、Q三点对应的平衡常数KM、KN、KQ的大小关系为______________ ;p1_______ (填”>””<”或”=”)p2;M、N点时,容器中物质的总物质的量之比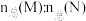 =
=______________ 。
| 容器 | 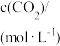 | 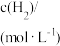 | 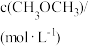 | 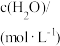 |  、 、 关系 |
| 容器I | 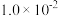 | 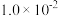 | 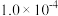 | 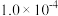 |  |
| 容器Ⅱ | 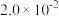 | 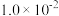 | 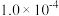 | 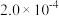 |
(1)容器I中的反应
(2)该反应在温度为T时的平衡常数K=
(3)容器Ⅱ中反应向
(4)从理论上分析,工业上合成二甲醚时,为提高H2的转化率,可采取的措施是
Ⅱ.在密闭容器中充入10molCO与20molH2合成CH3OH,反应为CO(g)+2H2(g) ⇌CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。

(5)则M、N、Q三点对应的平衡常数KM、KN、KQ的大小关系为
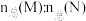 =
=
您最近一年使用:0次
解题方法
10 . 习近平总书记十分重视生态环境保护,多次对生态文明建设作出重要指示。试回答下列与环境有关的问题:
(1)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
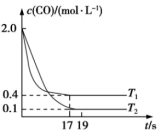
①该反应的正反应的ΔH___________ 0(填“>”或“<”)反应。
②温度为T2时,反应达到平衡时NO的转化率为___________ 。
③温度为T1时,该反应的平衡常数K=___________ 。
(2)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O ΔH<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
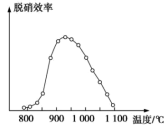
①SNCR技术脱硝的最佳温度为___________ ,SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是___________ 。
②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因是___________ 。
(1)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:

①该反应的正反应的ΔH
②温度为T2时,反应达到平衡时NO的转化率为
③温度为T1时,该反应的平衡常数K=
(2)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O ΔH<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:

①SNCR技术脱硝的最佳温度为
②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因是
您最近一年使用:0次



