1 . 氮硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g) N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g) 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
N2O2(g)+O2(g) 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g) N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
①2NO(g)+O2(g) 2NO2(g)△H=
2NO2(g)△H=______ kJ•mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______ ;
②某温度下反应2NO(g)+O2(g) 2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是
2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是__________________ mol•L-1•s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______ 倍。
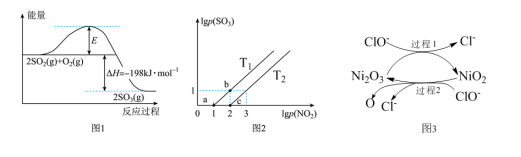
(2)2SO2(g)+O2(g) 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2 2V2O5(慢)
2V2O5(慢)
下列说法正确的是___________
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g) NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①根据题意可知:T1______ T2(填“>”“<”或者“=”),理由是___________________ 。
②由平衡状态a到b,改变的条件是__________________ 。
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式_______________________________ 。
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaClO更好,原因是________________ 。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g)
 N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)N2O2(g)
 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)N2O2(g)+O2(g)
 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)2NO2(g)
 N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)①2NO(g)+O2(g)
 2NO2(g)△H=
2NO2(g)△H=②某温度下反应2NO(g)+O2(g)
 2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是
2NO2(g)的速率常数k=8.8×10-2L2•mol-2•s-1,当反应物浓度都是0.05mol•L-1时,反应的速率是(2)2SO2(g)+O2(g)
 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)
 NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。①根据题意可知:T1
②由平衡状态a到b,改变的条件是
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaClO更好,原因是
您最近一年使用:0次
2 . 已知体积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:
(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为__________ mol/(L·s)。
(2)该反应的平衡常数K=___________ ,若降温其值增大,则该反应的ΔH_____ 0(填“>”或“<”或“=”)。
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为________ L(连通管中气体体积忽略不计,且不考虑温度的影响)。

(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是___________________ ;t6时保持压强不变向体系中充入少量He气,平衡____________ 移动。(填“向左”“向右”或“不”)。

 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为
(2)该反应的平衡常数K=
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为

(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是

您最近一年使用:0次
解题方法
3 . 反应N2(g)+3H2(g) 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
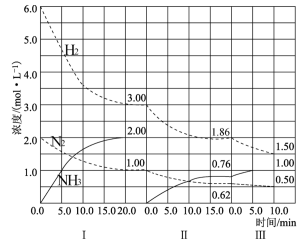
回答问题:
(1)在3个阶段中,N2的平均反应速率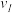 (N2)、
(N2)、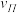 (N2)、
(N2)、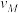 (N2)中最大的是
(N2)中最大的是________ ,其值是________ 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是________________ 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是_________ (填“正反应方向”或“逆反应方向”),采取的措施是____________________ 。
(4)第Ⅰ阶段时,化学平衡常数K1=___________ ;第Ⅱ、Ⅲ阶段化学平衡常数K2_________ K3;(填“>、<、=”)判断的理由是_________________ 。
 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)在3个阶段中,N2的平均反应速率
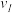 (N2)、
(N2)、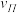 (N2)、
(N2)、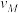 (N2)中最大的是
(N2)中最大的是(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是
(3)由第一次平衡到第二次平衡,平衡移动的方向是
(4)第Ⅰ阶段时,化学平衡常数K1=
您最近一年使用:0次
2016-12-09更新
|
519次组卷
|
2卷引用:2016-2017学年山西省太原五中高二上10月月考化学卷
解题方法
4 . 已知:NH2COO-+2H2O
 +NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
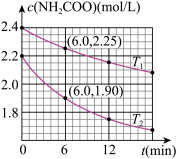

 +NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
| A.无法判断T1和T2的大小关系 |
| B.T1℃时,第6min反应物转化率为6.25% |
| C.T2℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1 |
| D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
您最近一年使用:0次
2016-12-09更新
|
867次组卷
|
4卷引用:2015届福建省龙岩市高三教学质量检查理综化学试卷
解题方法
5 . 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min时的平衡常数K=__________ ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)_______ T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__________ mol·L-1;
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__________ ;
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)______ v(15~16)(填“<”、“>”或“=”),原因是________________________ 。
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为______ ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH___ 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)_________________ 。
a、NH4HCO3 b、NH4A c、(NH4)2CO3 d、NH4Cl
(1)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min时的平衡常数K=
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH
a、NH4HCO3 b、NH4A c、(NH4)2CO3 d、NH4Cl
您最近一年使用:0次



