名校
1 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉部分变质 |
您最近一年使用:0次
2021-04-07更新
|
1029次组卷
|
16卷引用:安徽省芜湖市2022-2023学年高一上学期期末教学质量统测化学试题
安徽省芜湖市2022-2023学年高一上学期期末教学质量统测化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后天津市和平区2017-2018学年高一上学期期末考试化学试题安徽省芜湖市第一中学2020-2021学年高一上学期第二次月考化学试题辽宁省沈阳市2020-2021学年高一上学期期末质量监测化学试题山西省怀仁市2020-2021学年高一上学期期末考试化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(理)试题浙江省余姚中学2020-2021 学年高一上学期期中考试化学试题河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题(已下线)专题六 铁及其化合物(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)天津市静海区第一中学2021-2022学年高三上学期(9月)学生学业能力调研化学试题人教2019版必修第一册第三章 铁 金属材料复习与提高河南省洛阳市2021-2022学年高一上学期期末考试化学试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题
名校
2 . 以硫铁矿(主要成分为 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( ,
,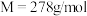 )的工艺流程如下:
)的工艺流程如下:
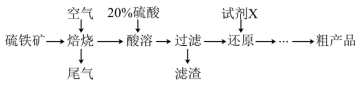
(1)滤渣的成分为___________ 。焙烧步骤中主要反应的化学方程式为___________ 。
(2)流程中省略的步骤含有①蒸发浓缩、冷却结晶②过滤③调溶液pH沉铝④洗涤、干燥,请写出正确顺序___________ (填序号,下同)。你认为获得粗产品后的母液进入___________ 操作中更合理。
(3)取 样品,加水完全溶解,滴加硫酸酸化的
样品,加水完全溶解,滴加硫酸酸化的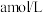
 溶液至恰好完全反应(
溶液至恰好完全反应( 被还原为
被还原为 ),消耗
),消耗 溶液
溶液 。则绿矾晶体纯度为
。则绿矾晶体纯度为___________ (可不化简)。
(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。F)对硫铁矿进行催化脱硫,同时得到 溶液。其过程如下图所示(其中
溶液。其过程如下图所示(其中 中S的平均化合价为
中S的平均化合价为 价):
价):
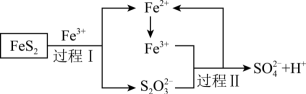
过程Ⅱ中氧化产物与还原产物的物质的量之比为___________ 。
(5) 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠( ),工业上有多种制备高铁酸钠方法。
),工业上有多种制备高铁酸钠方法。
①干法制备:主要反应为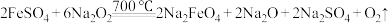 。从氧化还原反应的角度分析,
。从氧化还原反应的角度分析, 的作用为
的作用为___________ 。
②湿法制备:在碱性条件下,用 溶液和
溶液和 溶液反应制备。该反应的离子方程式为
溶液反应制备。该反应的离子方程式为___________ 。
 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( ,
,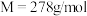 )的工艺流程如下:
)的工艺流程如下:
(1)滤渣的成分为
(2)流程中省略的步骤含有①蒸发浓缩、冷却结晶②过滤③调溶液pH沉铝④洗涤、干燥,请写出正确顺序
(3)取
 样品,加水完全溶解,滴加硫酸酸化的
样品,加水完全溶解,滴加硫酸酸化的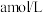
 溶液至恰好完全反应(
溶液至恰好完全反应( 被还原为
被还原为 ),消耗
),消耗 溶液
溶液 。则绿矾晶体纯度为
。则绿矾晶体纯度为(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。F)对硫铁矿进行催化脱硫,同时得到
 溶液。其过程如下图所示(其中
溶液。其过程如下图所示(其中 中S的平均化合价为
中S的平均化合价为 价):
价):
过程Ⅱ中氧化产物与还原产物的物质的量之比为
(5)
 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠( ),工业上有多种制备高铁酸钠方法。
),工业上有多种制备高铁酸钠方法。①干法制备:主要反应为
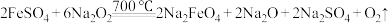 。从氧化还原反应的角度分析,
。从氧化还原反应的角度分析, 的作用为
的作用为②湿法制备:在碱性条件下,用
 溶液和
溶液和 溶液反应制备。该反应的离子方程式为
溶液反应制备。该反应的离子方程式为
您最近一年使用:0次
3 . 某实验室保存过氧化钠时方法不当导致过氧化钠试剂结块,表面为白色,将块状物敲开,内部呈现淡黄色。
(1)将该实验室过氧化钠药品用铝箔包裹(铝箔上用针扎出许多小孔)放入水中反应,写出其中产生气体的成分是_____ (填化学式)。
(2)甲组同学为测定制得的Na2O2样品的纯度,设计装置如图:
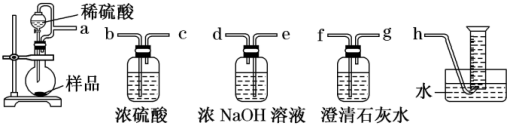
分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果_____ (填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是_____ 。
(3)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果_____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如表所示:
在上述实验中,能够证明乙组分析正确的最佳方案是_____ (填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是_____ 。
(4)丙组根据上述提供的有关信息:称取一定质量的样品(m克),加入少量MnO2固体,再用甲组同学设计的装置测定常温常压下生成O2体积,并换算成标准状况下氧气的体积为VL,计算该药品中过氧化钠的纯度为:_____ (不必化简)。
(1)将该实验室过氧化钠药品用铝箔包裹(铝箔上用针扎出许多小孔)放入水中反应,写出其中产生气体的成分是
(2)甲组同学为测定制得的Na2O2样品的纯度,设计装置如图:

分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果
(3)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果
| 实验方案 | 产生的现象 |
| I.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
| II.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| III.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
(4)丙组根据上述提供的有关信息:称取一定质量的样品(m克),加入少量MnO2固体,再用甲组同学设计的装置测定常温常压下生成O2体积,并换算成标准状况下氧气的体积为VL,计算该药品中过氧化钠的纯度为:
您最近一年使用:0次
4 . 某化学小组在实验室模拟高炉炼铁,其部分装置如下:
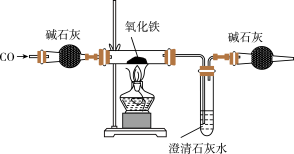
回答下列问题:
(1)该实验在通入CO之前要对气体进行__________ 操作。
(2)判断上述装置中CO与氧化铁发生反应的现象为__________ ;发生反应的化学方程式为__________ 。
(3)该装置存在的缺陷是__________ 。
(4)已知受热不均时。可发生副反应 。为测定所得
。为测定所得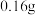 黑色产物(Fe和
黑色产物(Fe和 混合物)中铁的含量,进行如下实验。
混合物)中铁的含量,进行如下实验。
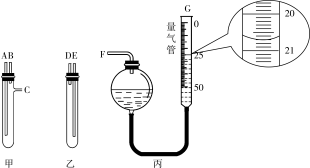
①甲、乙两试管中分别盛装样品和稀硫酸中的一种,样品应置于仪器______ (填“甲”或“乙”)中,用橡皮管连接对应接口后,倒置盛稀硫酸的试管,则A连接______ (填接口的字母)。
②当气体不再产生且恢复至室温时,正确摆放量气管后读数如丙图所示,量气管读数为______ mL。根据该读数并将产生的气体体积按标准状况计算(量气管原读数为0),产物中铁的质量分数为______ (保留一位小数)。

回答下列问题:
(1)该实验在通入CO之前要对气体进行
(2)判断上述装置中CO与氧化铁发生反应的现象为
(3)该装置存在的缺陷是
(4)已知受热不均时。可发生副反应
 。为测定所得
。为测定所得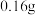 黑色产物(Fe和
黑色产物(Fe和 混合物)中铁的含量,进行如下实验。
混合物)中铁的含量,进行如下实验。①甲、乙两试管中分别盛装样品和稀硫酸中的一种,样品应置于仪器
②当气体不再产生且恢复至室温时,正确摆放量气管后读数如丙图所示,量气管读数为

您最近一年使用:0次
5 . 下列实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 取少量样品于试管中,加入稀 溶液,试管口放一张湿润红色石蕊试纸,观察现象 溶液,试管口放一张湿润红色石蕊试纸,观察现象 | 判断样品中是否含有 |
| B | 将炽热的木炭与浓硫酸混合后所得气体通入澄清石灰水中 | 验证碳的氧化产物为 |
| C | 将适量 气体通入硅酸钠溶液,观察能否出现白色胶状沉淀 气体通入硅酸钠溶液,观察能否出现白色胶状沉淀 | 比较Cl和Si元素非金属强弱 |
| D | 其他条件相同, 溶液和 溶液和 溶液反应,测定不同温度下出现乳白色浑浊所需时间 溶液反应,测定不同温度下出现乳白色浑浊所需时间 | 探究温度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-10更新
|
241次组卷
|
2卷引用:辽宁省大石桥市第三高级中学等三校2022-2023学年高一下学期5月期中联考化学试题
名校
解题方法
6 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
783次组卷
|
10卷引用:第1讲 钠及其重要化合物
(已下线)第1讲 钠及其重要化合物山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷山东省济南市商河县第三中学2022届高三10月月考化学试题2021年河北省高考化学试卷变式题10-18题广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)河南省顶级名校2023届高三上学期10月月考化学试题



