名校
1 . 某研究小组利用下图所示装置探究氯气的性质和氯气的刷备。
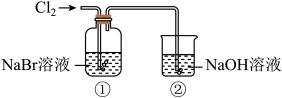
Ⅰ.氯气性质的探究
(1)实验室用 与浓盐酸反应制取
与浓盐酸反应制取 ,发生反应的化学方程式是
,发生反应的化学方程式是___________ 。利用了 的
的___________ (填“氧化性”或“还原性”)
(2)①中溶液由无色变为橙黄色,发生反应的离子方程式是___________ 。
(3)②中 溶液的作用是
溶液的作用是___________ ;发生反应的离子方程式是___________ 。若用排空气法收集一瓶氯气,可利用方框中的装置代替装置①,请将方框中的收集装置补充完整___________ 。
(4)取一支试管,加入 ①中橙黃色溶液,再滴入几滴
①中橙黃色溶液,再滴入几滴 -淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:
-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论: 的氧化性强于
的氧化性强于 ,理由是
,理由是___________ 。
Ⅱ.氯气制备的探究
某化学小组研究盐酸被 氧化的条件,进行如下实验:
氧化的条件,进行如下实验:
资料: 表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
(5)①已知 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是___________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是___________ 。
③Ⅲ中无明显现象的原因,可能是 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是___________ ;将ⅰ、ⅱ作对比,得出的结论是___________ 。

Ⅰ.氯气性质的探究
(1)实验室用
 与浓盐酸反应制取
与浓盐酸反应制取 ,发生反应的化学方程式是
,发生反应的化学方程式是 的
的(2)①中溶液由无色变为橙黄色,发生反应的离子方程式是
(3)②中
 溶液的作用是
溶液的作用是
(4)取一支试管,加入
 ①中橙黃色溶液,再滴入几滴
①中橙黃色溶液,再滴入几滴 -淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:
-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论: 的氧化性强于
的氧化性强于 ,理由是
,理由是Ⅱ.氯气制备的探究
某化学小组研究盐酸被
 氧化的条件,进行如下实验:
氧化的条件,进行如下实验:| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将 和 和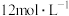 浓盐酸混合 浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅱ | 加热 和 和 稀盐酸混合物 稀盐酸混合物 | 无明显现象 |
 表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。
表示盐酸的浓度,用符号c表示。数值越大表示浓度越高。(5)①已知
 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是
 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
解题方法
2 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。
(1)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
I.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
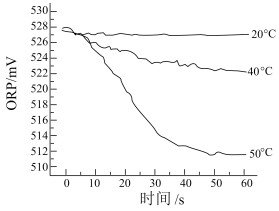
III.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
①已知白醋显酸性,不具有漂白性。实验I、II现象不同的原因是_______ 。
②由实验III可得出的结论是_______ 。ORP值不同的原因可能是_______ 。
(3)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______  。
。
(4)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 将
将 氧化产生的
氧化产生的 促进藻类快速生长。写出该反应的化学方程式:
促进藻类快速生长。写出该反应的化学方程式:_______ 。
| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 4.需稀释后使用,勿口服。 |
(1)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有
 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。I.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验I、II现象不同的原因是
②由实验III可得出的结论是
(3)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
 。
。(4)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
 将
将 氧化产生的
氧化产生的 促进藻类快速生长。写出该反应的化学方程式:
促进藻类快速生长。写出该反应的化学方程式:
您最近一年使用:0次
名校
3 . 某小组研究 溶液与KI溶液的反应,实验记录如下:
溶液与KI溶液的反应,实验记录如下:
【资料】:ⅰ. 溶液呈碱性。
溶液呈碱性。
ⅱ. 在
在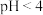 并加热的条件下极不稳定。
并加热的条件下极不稳定。
ⅲ.碘的化合物主要以 和
和 的形式存在。
的形式存在。
ⅳ.酸性条件下 不能氧化
不能氧化 ,可以氧化
,可以氧化 。
。
(1) 的电子式为:
的电子式为:_______ 。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是_______ 。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
①提出假设a: 在碱性溶液中不能存在。
在碱性溶液中不能存在。
设计实验Ⅲ证实了假设a成立,补充实验Ⅲ的操作及现象:向_______ 溶液中加入少量滴有淀粉溶液的碘水。振荡,观察到_______ 。
②提出假设b: 可将
可将 氧化为
氧化为 。
。
进行实验也证实了假设b成立。
(4)检验实验Ⅱ所得溶液中的 :取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的
:取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的 。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在
。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在 。
。
①产生的黄绿色气体是_______ 。
②有同学认为此实验不能说明实验Ⅱ所得溶液中存在 ,理由是
,理由是_______ 。欲证明实验Ⅱ所得溶液中存在 ,改进的实验方案是
,改进的实验方案是_______ 。
③实验Ⅱ中反应的离子方程式是_______ 。
 溶液与KI溶液的反应,实验记录如下:
溶液与KI溶液的反应,实验记录如下:| 实验编号 | 实验操作 | 实验现象 | |
| Ⅰ |  | ⅰ.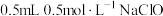 溶液 溶液ⅱ.几滴淀粉溶液、 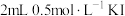 溶液 溶液 | ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ |  | ⅰ. 溶液 溶液ⅱ.几滴淀粉溶液、 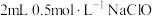 溶液 溶液 | ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的  |
 溶液呈碱性。
溶液呈碱性。ⅱ.
 在
在 并加热的条件下极不稳定。
并加热的条件下极不稳定。ⅲ.碘的化合物主要以
 和
和 的形式存在。
的形式存在。ⅳ.酸性条件下
 不能氧化
不能氧化 ,可以氧化
,可以氧化 。
。(1)
 的电子式为:
的电子式为:(2)实验Ⅰ中溶液变为浅黄色的离子方程式是
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
①提出假设a:
 在碱性溶液中不能存在。
在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,补充实验Ⅲ的操作及现象:向
②提出假设b:
 可将
可将 氧化为
氧化为 。
。进行实验也证实了假设b成立。
(4)检验实验Ⅱ所得溶液中的
 :取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的
:取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的 。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在
。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在 。
。①产生的黄绿色气体是
②有同学认为此实验不能说明实验Ⅱ所得溶液中存在
 ,理由是
,理由是 ,改进的实验方案是
,改进的实验方案是③实验Ⅱ中反应的离子方程式是
您最近一年使用:0次
名校
解题方法
4 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为_______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
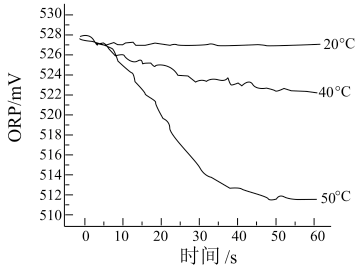
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是_______ 。
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______ mol∙L−1。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 4.需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
2021-01-24更新
|
573次组卷
|
4卷引用:河南省济源高级中学2022-2023学年高一下学期期末综合练习化学试题
解题方法
5 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______ (填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______ (用离子方程式表示,)。
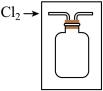
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
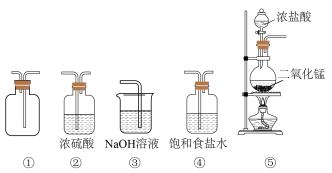
A.上述仪器的正确顺序(用序号表示):_______ ;
B.②装置中,浓硫酸的作用是_______ ;
C.⑤装置中发生反应的离子方程式为:_______ 。
(1)实验室制Cl2的反应中,浓盐酸所起的作用有
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:

A.上述仪器的正确顺序(用序号表示):
B.②装置中,浓硫酸的作用是
C.⑤装置中发生反应的离子方程式为:
您最近一年使用:0次
2023-02-10更新
|
62次组卷
|
2卷引用:宁夏银川市贺兰县景博中学2022-2023学年高一下学期第一次质量检测化学试题
6 . 高铁酸钠是用次氯酸钠和氢氧化铁在一定条件下制备的,
(1)请配平制备的反应方程式并标出电子转移的方向和数目:________
________NaClO+ ________Fe(OH)3+ ________= ________Na2FeO4+________NaCl+ ________H2O
(2)氧化剂是___________ ,________ 元素被氧化。
(3)高铁酸钠被用作消毒剂是因为具有___________ 性,其产物是三价铁,Fe3+水解生成的Fe(OH)3分散系属于___________ (填 “浊液”、“胶体”或“溶液”),能够吸附水中的固体颗粒物,达到净水的目的。
(4)某学生根据课堂知识: ClO-在酸性环境下的氧化性更强,准备用含次氯酸的溶液和硫酸铁去制备高铁酸或者高铁酸盐,结果失败了。排除实验操作问题,根据氧化还原反应的知识与本题信息,下列判断可能正确的是:________ 。
A.碱性环境下三价铁的还原性更强
B.酸性环境下高铁酸根离子的氧化性太强
C.碱性环境下高铁酸钠的氧化性不强
(1)请配平制备的反应方程式并标出电子转移的方向和数目:
________NaClO+ ________Fe(OH)3+ ________= ________Na2FeO4+________NaCl+ ________H2O
(2)氧化剂是
(3)高铁酸钠被用作消毒剂是因为具有
(4)某学生根据课堂知识: ClO-在酸性环境下的氧化性更强,准备用含次氯酸的溶液和硫酸铁去制备高铁酸或者高铁酸盐,结果失败了。排除实验操作问题,根据氧化还原反应的知识与本题信息,下列判断可能正确的是:
A.碱性环境下三价铁的还原性更强
B.酸性环境下高铁酸根离子的氧化性太强
C.碱性环境下高铁酸钠的氧化性不强
您最近一年使用:0次
2022-03-16更新
|
555次组卷
|
2卷引用:云南省普洱市第一中学2022-2023学年高一下学期期末考试化学试题
7 . 下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式 回答,(5)~(8)小题按题目要求回答。
(1)表中元素,化学性质最不活泼的是_______ ,只有负价而无正价的是_______ ,氧化性最强的单质是_______ ,还原性最强的单质是_______ 。
(2)最高价氧化物的水化物碱性最强的是_______ ,酸性最强的是_______ ,呈两性的是_______ 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的_______ 。
(4)在B、C、E、F、G、H中,原子半径最大的是_______ 。
(5)A和D组成化合物的电子式_______ 。
(6)用电子式表示B和H组成化合物的形成过程_______ 。
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式_______
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的
(4)在B、C、E、F、G、H中,原子半径最大的是
(5)A和D组成化合物的电子式
(6)用电子式表示B和H组成化合物的形成过程
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
您最近一年使用:0次
名校
8 . 下列有关性质的比较,不正确的是
| A.金属性:Na>K | B.氧化性: |
C.还原性: | D.碱性: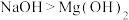 |
您最近一年使用:0次
2023-12-29更新
|
381次组卷
|
5卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高一上学期12月月考化学试题
云南省昆明市云南师范大学附属中学2023-2024学年高一上学期12月月考化学试题(已下线)寒假作业10 元素周期律-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)福建省福州市九师教学联盟2023-2024学年高一上学期期末学业联考化学试题河北省衡水市安平中学2023-2024学年高一下学期开学考试化学试题云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
名校
9 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)从元素原子得失电子的角度看,元素⑤具有___________ (填“氧化性”或“还原性”)。
(2)元素②形成的单质气体含有___________ (填“极性”或“非极性”)共价键。
(3)元素③、⑨与H原子以原子个数比为1∶1∶1形成的化合物的电子式为___________ 。
(4)第三周期中元素的最高价氧化物对应水化物中碱性最强的是___________ (填化学式,下同),最高价氧化物对应的水化物具有两性的物质是___________ ,这两种物质反应的离子方程式为___________ 。
(5)元素③、⑤、⑨形成简单离子的半径由大到小的顺序是___________ (填离子符号)。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)从元素原子得失电子的角度看,元素⑤具有
(2)元素②形成的单质气体含有
(3)元素③、⑨与H原子以原子个数比为1∶1∶1形成的化合物的电子式为
(4)第三周期中元素的最高价氧化物对应水化物中碱性最强的是
(5)元素③、⑤、⑨形成简单离子的半径由大到小的顺序是
您最近一年使用:0次
名校
10 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
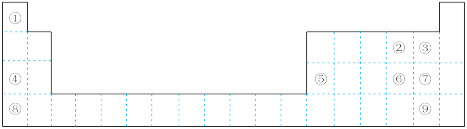
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为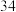
B.气态氢化物的稳定性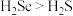
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
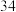
B.气态氢化物的稳定性
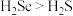
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题



