名校
解题方法
1 . N、P元素在工业上应用广泛。请回答下列问题:
(1)次磷酸(H3PO2)常用于化学镀银,发生的反应如下:4Ag++H3PO2+2H2O=4Ag↓+H3PO4+4H+
①H3PO2中,P元素的化合价为___________ 。
②该反应中,表现氧化性与表现还原性的微粒个数之比为___________ 。
③已知H3PO2是一元弱酸,写出其与足量NaOH溶液反应的化学方程式:___________ 。
(2)近几年来关于氮污染的治理备受关注。三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NO2三种成分的净化,其催化剂表面物质转化的关系如图所示。

①上图中,物质X中含有NO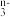 ,已知NO
,已知NO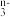 和氟气可发生如下反应:NO
和氟气可发生如下反应:NO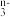 +F2+2OH-=RO
+F2+2OH-=RO +2F-+H2O,则NO
+2F-+H2O,则NO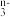 中,元素N的化合价为
中,元素N的化合价为___________ ,X的化学式为___________ 。
②在图示的转化中,被还原的元素是___________ 。
(1)次磷酸(H3PO2)常用于化学镀银,发生的反应如下:4Ag++H3PO2+2H2O=4Ag↓+H3PO4+4H+
①H3PO2中,P元素的化合价为
②该反应中,表现氧化性与表现还原性的微粒个数之比为
③已知H3PO2是一元弱酸,写出其与足量NaOH溶液反应的化学方程式:
(2)近几年来关于氮污染的治理备受关注。三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NO2三种成分的净化,其催化剂表面物质转化的关系如图所示。

①上图中,物质X中含有NO
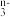 ,已知NO
,已知NO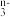 和氟气可发生如下反应:NO
和氟气可发生如下反应:NO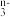 +F2+2OH-=RO
+F2+2OH-=RO +2F-+H2O,则NO
+2F-+H2O,则NO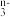 中,元素N的化合价为
中,元素N的化合价为②在图示的转化中,被还原的元素是
您最近一年使用:0次
名校
2 . 有下列物质:①Ba(OH)2固体;②KHCO3固体;③HNO3;④稀硫酸;⑤CO2;⑥铜;⑦Fe(OH)3胶体;⑧CH3COOH;⑨FeCl3固体。
(1)属于非电解质的是___________ (填序号,下同)。
(2)写出制备⑦的化学方程式___________ 。
(3)写出KHCO3在水溶液中的电离方程式:___________ 。
(4)写出①的溶液与②的溶液恰好完全中和时的离子方程式:___________ 。
(5)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(σ)随新物质加入量(V)的变化曲线如图所示。与C曲线变化趋势一致的是___________ (按字母顺序填序号)。

①向氨水中通入HCl气体直至过量
②向饱和石灰水中不断通入CO2
③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量
(1)属于非电解质的是
(2)写出制备⑦的化学方程式
(3)写出KHCO3在水溶液中的电离方程式:
(4)写出①的溶液与②的溶液恰好完全中和时的离子方程式:
(5)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(σ)随新物质加入量(V)的变化曲线如图所示。与C曲线变化趋势一致的是

①向氨水中通入HCl气体直至过量
②向饱和石灰水中不断通入CO2
③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量
您最近一年使用:0次
名校
3 . 甘肃马家窑遗址(今临洮县)出土的青铜刀,是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,其化学式为Cu2(OH)2CO3。
(1)从物质分类标准看,“铜绿”属于哪类物质___________。(填选项)
(2)铜器表面有时会生成“铜绿”,这层“铜绿”可用化学方法除去,写出盐酸去除“铜绿”的化学方程式:___________ 。
(3)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:反应Ⅰ:2Cu2S+3O2 2Cu2O+2SO2,反应Ⅱ:Cu2S+2Cu2O
2Cu2O+2SO2,反应Ⅱ:Cu2S+2Cu2O 6Cu+SO2↑,请回答下列问题:
6Cu+SO2↑,请回答下列问题:
①反应Ⅰ中,氧化产物是___________ ,用单线桥标出反应Ⅰ中电子转移的方向和数目________ 。
②反应Ⅱ中,Cu2O的作用是___________ (填“氧化剂”“还原剂”或“氧化剂和还原剂”)。
(1)从物质分类标准看,“铜绿”属于哪类物质___________。(填选项)
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(3)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:反应Ⅰ:2Cu2S+3O2
 2Cu2O+2SO2,反应Ⅱ:Cu2S+2Cu2O
2Cu2O+2SO2,反应Ⅱ:Cu2S+2Cu2O 6Cu+SO2↑,请回答下列问题:
6Cu+SO2↑,请回答下列问题:①反应Ⅰ中,氧化产物是
②反应Ⅱ中,Cu2O的作用是
您最近一年使用:0次
4 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
(1)从物质分类角度来看, 是
是___________ (填序号)。
a.酸 b.盐 c.碱 d.非电解质 e.电解质
(2)由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:___________

(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出
表现出___________ (填“氧化性”或“还原性”)。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。(1)从物质分类角度来看,
 是
是a.酸 b.盐 c.碱 d.非电解质 e.电解质
(2)由于
 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出
表现出(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:
您最近一年使用:0次
名校
5 . 回答下列问题。
Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为___________  。(保留一位小数)
。(保留一位小数)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是___________ (填仪器名称)

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是___________ 。
(3)请将下列各操作按正确的顺序将字母代号填写在横线上___________ 。
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(4)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
(5)某工厂将氯气通入到40%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度) 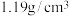 |
 。(保留一位小数)
。(保留一位小数)(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是
(3)请将下列各操作按正确的顺序将字母代号填写在横线上
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(4)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
| A.配制前,容量瓶中有少量蒸馏水 | B.洗涤液未转移到容量瓶中 |
| C.未经冷却立即转液 | D.定容时,仰视溶液的凹液面 |
您最近一年使用:0次
名校
解题方法
6 . 2021年10月16日,载有三名航天员的神舟十三号载人飞船顺利进入太空。运载火箭和载人飞船使用了大量铝材,实现了多项科技创新。
(1)运载火箭和载人飞船上使用的铝材属于___________ (填“纯铝”或“铝合金”),其优点是___________ (写一条)。
(2)生产铝材时,可用NaOH溶液除去铝材表面的天然氧化膜,反应的离子方程式是___________ 。
(3)除去单质铁中含有的少量铝涉及到的离子方程式是___________ 。
(4)为了探究铁及其化合物的氧化性和还原性,某同学进行如下实验。补全下表。
(1)运载火箭和载人飞船上使用的铝材属于
(2)生产铝材时,可用NaOH溶液除去铝材表面的天然氧化膜,反应的离子方程式是
(3)除去单质铁中含有的少量铝涉及到的离子方程式是
(4)为了探究铁及其化合物的氧化性和还原性,某同学进行如下实验。补全下表。
| 序号 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| Ⅰ | 将一段打磨过的铁丝放入CuSO4溶液中,充分反应 | 溶液蓝色变浅,铁丝表面析出红色固体 | Fe具有还原性 | |
| Ⅱ | 向FeCl3溶液中加入过量铁粉 | Fe3+具有氧化性 | ||
| 向盛有FeCl3溶液的试管中滴加3滴KI溶液,然后滴加2滴淀粉溶液 | 溶液棕黄色加深,滴加淀粉溶液后变蓝色 | |||
| Ⅲ | 向FeCl2溶液中加入过量光亮的锌片,充分反应 | 浅绿色溶液变无色,锌片表面变暗 | Fe2+ + Zn= Fe + Zn2+ | |
| Ⅳ | 向FeCl2溶液中滴加新制的氯水 | 浅绿色溶液变棕黄色 | Fe2+具有还原性 |
您最近一年使用:0次
名校
7 . 根据所学知识填写下列空白。
(1)在标准状况下,6.72 L CO2质量为___________ g,其中含有氧原子数目为___________ 。
(2)在标准状况下,3.4 g氨气所占的体积约为___________ L,它与同条件下___________ mol H2S含有相同的氢原子数。
(3)V L Fe2(SO4)3溶液中含有a g SO ,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO
,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO 的物质的量浓度为
的物质的量浓度为___________ 。
(4)下列数量的各物质,所含原子个数由大到小的顺序是___________ (填序号)。
①0.5 mol SO3 ②标准状况下22.4 L He
③4℃时9 mL水(水的密度为1 g/mL) ④0.2 mol CH3COONH4
(5)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为___________ 。
(1)在标准状况下,6.72 L CO2质量为
(2)在标准状况下,3.4 g氨气所占的体积约为
(3)V L Fe2(SO4)3溶液中含有a g SO
 ,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO
,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO 的物质的量浓度为
的物质的量浓度为(4)下列数量的各物质,所含原子个数由大到小的顺序是
①0.5 mol SO3 ②标准状况下22.4 L He
③4℃时9 mL水(水的密度为1 g/mL) ④0.2 mol CH3COONH4
(5)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为
您最近一年使用:0次
名校
解题方法
8 . 由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)明胶的水溶液和淀粉溶液共同具备的性质是________ (填字母)。
(2)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1mol/L的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和浓液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
①其中操作正确的同学是________ ,化学反应方程式:_________ 。
②证明有Fe(OH) 3胶体生成的实验操作是_________ ;FeCl3饱和溶液和Fe(OH)3胶体根本区别是________ 。
③在胶体中加入电解质溶液或带有相反电荷的胶体粒子能使胶体粒子沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
a.将其装入U形管内,用石墨作电极,通电一段时间后发现阴极区附近的颜色逐渐变深,这表明________ 。
b.向其中加入饱和K2SO4溶液,产生的现象是________ 。
(1)明胶的水溶液和淀粉溶液共同具备的性质是
| A.都不稳定,密封放置沉淀 | B.都能产生丁达尔效应 |
| C.分散质粒子可通过滤纸 | D.分散质粒子可通过半透膜 |
甲同学:向1mol/L的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和浓液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
①其中操作正确的同学是
②证明有Fe(OH) 3胶体生成的实验操作是
③在胶体中加入电解质溶液或带有相反电荷的胶体粒子能使胶体粒子沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
a.将其装入U形管内,用石墨作电极,通电一段时间后发现阴极区附近的颜色逐渐变深,这表明
b.向其中加入饱和K2SO4溶液,产生的现象是
您最近一年使用:0次
名校
9 . ①Cu丝;②熔融的MgCl2;③NaCl溶液;④蔗糖;⑤CH3COOH;⑥CaCO3;⑦Na2CO3;⑧CO2;⑨氨水,请用相应的数字编号和化学用语回答问题:
(1)属于混合物的有________ 。
(2)属于盐的有________ 。
(3)属于电解质的是_________ 。
(4)能导电的是_________ 。
(5)属于非电解质的是_________ 。
(6)请写出下列物质的电离方程式:①NaHSO4_________ 。②NaHCO3________ 。
(1)属于混合物的有
(2)属于盐的有
(3)属于电解质的是
(4)能导电的是
(5)属于非电解质的是
(6)请写出下列物质的电离方程式:①NaHSO4
您最近一年使用:0次
名校
10 . 回答下列问题
(1)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,其中被氧化的元素是___________ (填元素名称)。
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在。Fe2+易被人体吸收,服用维生素C,可使Fe3+转换成Fe2+,有利于人体吸收,说明维生素C具有___________ (填“氧化性”或“还原性”)。
(3)工业废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放。工业上常用明矾(FeSO4•7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O
)有毒,必须处理达标后才能排放。工业上常用明矾(FeSO4•7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O,在该反应中,氧化剂是
+14H+=6Fe3++2Cr3++7H2O,在该反应中,氧化剂是___________ (填离子符号,下同),被氧化的是___________ 。
(4)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式___________ 。
(1)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,其中被氧化的元素是
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在。Fe2+易被人体吸收,服用维生素C,可使Fe3+转换成Fe2+,有利于人体吸收,说明维生素C具有
(3)工业废水中含有的重铬酸根离子(Cr2O
 )有毒,必须处理达标后才能排放。工业上常用明矾(FeSO4•7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O
)有毒,必须处理达标后才能排放。工业上常用明矾(FeSO4•7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O,在该反应中,氧化剂是
+14H+=6Fe3++2Cr3++7H2O,在该反应中,氧化剂是(4)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
您最近一年使用:0次



