名校
解题方法
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: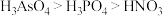
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
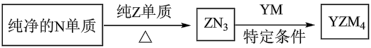
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
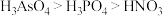
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
名校
解题方法
2 . 硒 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来,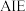 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型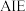 分子IV的合成路线如下:
分子IV的合成路线如下: 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为_______ 。
(2) 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
_______  (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是_______ ;热稳定性:
_______  。
。
(3)研究发现,给小鼠喂食适量硒酸钠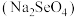 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。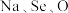 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为_______ 。
(4)反应物III的部分结构与肼 十分相似,
十分相似, 的电子式为
的电子式为_______ 。以 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼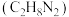 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为_______ 。
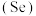 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来,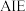 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型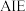 分子IV的合成路线如下:
分子IV的合成路线如下: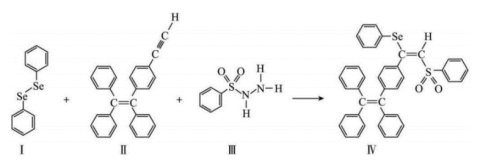
 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为(2)
 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
 (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是
 。
。(3)研究发现,给小鼠喂食适量硒酸钠
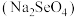 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。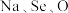 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为(4)反应物III的部分结构与肼
 十分相似,
十分相似, 的电子式为
的电子式为 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼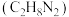 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
2023-03-24更新
|
270次组卷
|
2卷引用:湖北省名校3月联考2022-2023学年高一下学期化学试题
名校
解题方法
3 . 如图是部分短周期主族元素原子半径与原子序数的关系图。
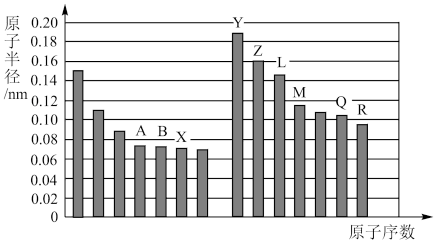
回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置__________ 。比较Z、Q两种元素的简单离子半径大小__________ ;
M的原子结构示意图为__________ ;B单质的电子式为__________ ,B的氢化物空间构型为__________
(2)图中最活泼的金属是__________ ,将其单质在氧气中加热,生成的产物为__________ 。
(3)比较Q、R两种元素的简单气态氢化物的沸点高低__________ ,并从原子结构角度解释其原因________________ ;
(4)B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为__________ ;现象为__________ 。
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:________ (注明操作、现象及结论)

回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置
M的原子结构示意图为
(2)图中最活泼的金属是
(3)比较Q、R两种元素的简单气态氢化物的沸点高低
(4)B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:
您最近一年使用:0次
名校
4 . 元素周期表体现了元素“位-构-性”的关系,下图是元素周期表的一部分,回答下列问题:
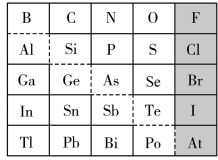
(1)Ga元素的原子结构示意图如图所示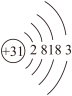 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为___________ 。
(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为___________ ,可作___________ 材料使用;Bi元素的最高价氧化物为___________ (填化学式,下同);I元素的最高价氧化物对应的水化物为___________ 。
(3)以上元素中,失电子能力最强的元素是___________ ,非金属性最强的元素是___________ 。
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是___________ 。
②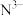 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:___________ (用离子符号排序)。
③ 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:___________ 。

(1)Ga元素的原子结构示意图如图所示
 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为
(3)以上元素中,失电子能力最强的元素是
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是
②
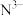 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:③
 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:
您最近一年使用:0次
名校
5 . 如图是部分短周期主族元素原子半径与原子序数的关系图。

回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置_______ 。比较Z、Q两种元素的简单离子半径大小_______ ;M的原子结构示意图为_______ 。
(2)图中最活泼的金属是_______ ,将其单质在氧气中加热,生成的产物为_______ 。该元素的最高价氧化物对应的水化物与L的最高价氧化物对应的水化物发生反应的离子方程式为_______ 。
(3)比较X、R两种元素的简单气态氢化物的沸点高低_______ ;B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为_______ ;现象为_______ 。
(4)最高价氧化物的水化物中酸性最强的是_______ 。
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:_______ (注明操作、现象及结论)。

回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置
(2)图中最活泼的金属是
(3)比较X、R两种元素的简单气态氢化物的沸点高低
(4)最高价氧化物的水化物中酸性最强的是
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:
您最近一年使用:0次
名校
解题方法
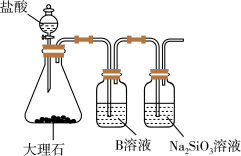
6 . 1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
(1)Sn的最高正价为_______ ,I的最高价氧化物对应水化物的化学式为_______ ,Bi的最高价氧化物为_______ 。
(2)元素Ga在元素周期表中的位置为:_______ 。
(3)根据元素周期律等有关知识,推断:
①阴影部分元素的氢化物沸点最高的是_______ (填化学式)。
②N3-、O2-、Al3+、S2-,四种离子半径大小顺序:_______ (用离子符号排序)。
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:_______ 。
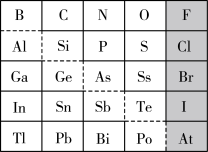
(4)查阅资料可知:硅酸(H2SiO3)是一种难溶于水的弱酸。为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用_______ 溶液,作用是_______ ,其中能说明C和Si非金属性强弱的化学方程式是:_______ 。

(1)Sn的最高正价为
(2)元素Ga在元素周期表中的位置为:
(3)根据元素周期律等有关知识,推断:
①阴影部分元素的氢化物沸点最高的是
②N3-、O2-、Al3+、S2-,四种离子半径大小顺序:
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:
(4)查阅资料可知:硅酸(H2SiO3)是一种难溶于水的弱酸。为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用

您最近一年使用:0次
7 . 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
回答下列问题:
(1)j在元素周期表中的位置是______ 。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________ 。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______ 色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______ 。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____ Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______ 。
| a | b | |||||||
| c | d | e | f | |||||
| g | h | i | j | k | l | m | ||
| n |
(1)j在元素周期表中的位置是
(2)e、h、m形成的简单离子其半径由大到小的顺序为
(3)n与g形成的化合物为
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释
您最近一年使用:0次
2022-01-14更新
|
783次组卷
|
4卷引用:【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】
(已下线)【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】湖南省怀化市2021-2022学年高一上学期期末考试化学试题(已下线)第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题
名校
解题方法
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
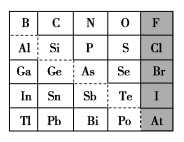
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1569次组卷
|
6卷引用:内蒙古通辽市开鲁县第一中学2022-2023学年高一上学期期末考试化学试题
9 . 元素周期律(表)是认识元素化合物性质的重要理论。
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是___________________ (用“>”“=”或“<”)。
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2_____ Ba (OH)2(填“>”或“<”)。
②用原子结构的观点解释锶的化学性质与钡差异的原因:______________________________
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
①Se在元素周期表中的位置是_______________ 。
②H2Se的电子式是______________ 。
③Cl、Se、Br的非金属性强弱的顺序是__________________ ;能证明上述强弱关系的事实是____________________________ (写出一条即可)。
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈
ⅱ.锂和镁的氢氧化物均为中等强度的碱
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物
根据以上事实,可知锂、钠、镁三种元素的金属性强弱关系是
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
①碱性:Sr(OH)2
②用原子结构的观点解释锶的化学性质与钡差异的原因:
(3)硒(Se)的部分信息如图,且知34Se、35Br位于同一周期。
| O | |
| S | |
| Se | Br |
②H2Se的电子式是
③Cl、Se、Br的非金属性强弱的顺序是
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的。完成下表:
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | SeO2+2SO2+2H2O=Se+2H2SO4 |
| 2 | ||
| 3 |
您最近一年使用:0次
2020-04-13更新
|
308次组卷
|
2卷引用:章末检测卷(四) 物质结构 元素周期律
名校
解题方法
10 . 元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
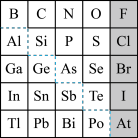
(1)元素Ga在元素周期表中的位置为:第_____ 周期第____ 族。
(2)Sn的最高正价为____ ,Cl的最高价氧化物对应水化物的化学式为___ ,Bi的最高价氧化物为_____ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是______ 元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4______ H2SeO4(填“>”“<”或“=”)。
③氢化物的还原性:H2O______ H2S(填“>”“<”或“=”)。
④原子半径比较:N______ Si(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)________ 。

(1)元素Ga在元素周期表中的位置为:第
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
(4)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)
您最近一年使用:0次
2020-02-08更新
|
311次组卷
|
4卷引用:山东省淄博市淄川中学2022-2023学年高一上学期期末学情自测化学试题



