名校
解题方法
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期。N、X最外层电子数相同,2原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)镓( )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是___________ (填字母)。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
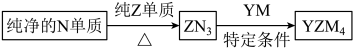
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
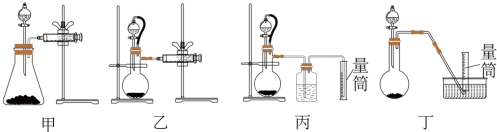
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(
 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
名校
解题方法
2 . a、b、c、d、e为五种短周期主族元素,原子序数依次递增。下图是a~e五种元素的单质及其化合物(或其溶液)的转化关系。已知A为金属单质,E为淡黄色固体,B、C、D是非金属单质,且在常温常压下都是气体,D常用于自来水的杀菌、消毒,化合物F通常状况下呈气态。请回答下列问题:

(1)d在元素周期表中的位置位于___________ , 的电子式为
的电子式为___________ 。
(2)e的单质与d的最高价氧化物对应的水化物反应的化学方程式是___________ 。
(3) 可在呼吸面具中作为氧气来源,假设每人每分钟消耗
可在呼吸面具中作为氧气来源,假设每人每分钟消耗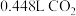 (标准状况),且所需的
(标准状况),且所需的 全部由
全部由 来提供,则某消防员工作1小时所需
来提供,则某消防员工作1小时所需 的质量为
的质量为___________ g。
(4)b、c、d元素中,原子半径由小到大的顺序是___________ (填元素符号);c、d、e元素分别形成的简单离子中离子半径最小的是___________ (填离子符号)。
(5)b和e两元素相比较,非金属性较强是___________ (填元素符号),可以证明该结论的是___________ 。
A.e的气态氢化物比b的气态氢化物稳定
B.b氧化物对应的水化物的酸性弱于e氧化物对应的水化物的酸性
C.b的简单氢化物的沸点比e的氢化物沸点低
D.b和e形成的化合物中的化合价b为正价,e为负价

(1)d在元素周期表中的位置位于
 的电子式为
的电子式为(2)e的单质与d的最高价氧化物对应的水化物反应的化学方程式是
(3)
 可在呼吸面具中作为氧气来源,假设每人每分钟消耗
可在呼吸面具中作为氧气来源,假设每人每分钟消耗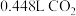 (标准状况),且所需的
(标准状况),且所需的 全部由
全部由 来提供,则某消防员工作1小时所需
来提供,则某消防员工作1小时所需 的质量为
的质量为(4)b、c、d元素中,原子半径由小到大的顺序是
(5)b和e两元素相比较,非金属性较强是
A.e的气态氢化物比b的气态氢化物稳定
B.b氧化物对应的水化物的酸性弱于e氧化物对应的水化物的酸性
C.b的简单氢化物的沸点比e的氢化物沸点低
D.b和e形成的化合物中的化合价b为正价,e为负价
您最近一年使用:0次
名校
3 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
238次组卷
|
2卷引用:四川省内江市第六中学2022-2023学年高一下学期入学考试化学试题
解题方法
4 . X、Y、Z、M为原子序数依次增大的四种短周期主族元素,c、a、b、d分别是X、Y、Z、M元素的单质,e、f、g是它们组成的化合物,转化关系如图所示,其中e是一元强酸,f的焰色试验为黄色。
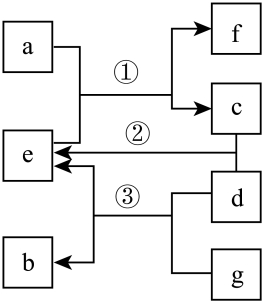
请回答下列问题:
(1)Z在元素周期表中的位置为___________ 。
(2)a及a同主族金属单质的保存方法为___________ 。
(3)c在d中燃烧的现象为___________ 。
(4)X、Y、Z、M四种元素对应的简单离子的半径由大到小的顺序为___________ (填离子符号)。
(5)f的电子式为___________ ,g的结构式为___________ 。
(6)X与Y形成的化合物与水反应生成4g c时,转移电子数为___________ 。

请回答下列问题:
(1)Z在元素周期表中的位置为
(2)a及a同主族金属单质的保存方法为
(3)c在d中燃烧的现象为
(4)X、Y、Z、M四种元素对应的简单离子的半径由大到小的顺序为
(5)f的电子式为
(6)X与Y形成的化合物与水反应生成4g c时,转移电子数为
您最近一年使用:0次
名校
5 . X、Y、Z、W、M为五种短周期元素,且原子序数依次增大。X与W、Z与M分别同主族,M的原子最外层电子数比次外层少2个。X与Y可以按照原子个数比3:1形成化合物A,1个A分子中含有10个电子。请回答:
(1)Y在周期表中的位置是___________ 。
(2)甲、乙、丙为三种强电解质,分别由上述五种元素中的三种组成。甲、乙、丙的稀溶液之间存在如下转化关系:

①乙、丙溶液混合加热的离子方程式为:___________ 。
②金属Cu与甲、乙的混合溶液反应的离子方程式为:___________ 。
(3)化合物WY3是合成抗禽流感药物“达菲”的中间物质,WY3受撞击会生成一种非金属单质和一种化合物W3Y,请写出该反应的化学方程式___________ 。若反应生成标准状况下33.6L气体单质,则电子转移的物质的量为___________ mol。
(1)Y在周期表中的位置是
(2)甲、乙、丙为三种强电解质,分别由上述五种元素中的三种组成。甲、乙、丙的稀溶液之间存在如下转化关系:

①乙、丙溶液混合加热的离子方程式为:
②金属Cu与甲、乙的混合溶液反应的离子方程式为:
(3)化合物WY3是合成抗禽流感药物“达菲”的中间物质,WY3受撞击会生成一种非金属单质和一种化合物W3Y,请写出该反应的化学方程式
您最近一年使用:0次
解题方法
6 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
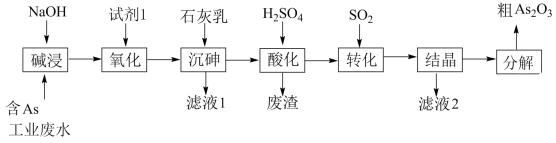
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
名校
7 . Ⅰ.短周期元素X、Y、Z、W、Q的原子序数依次增大,Z的原子半径是短周期主族元素中最大的,X、Y、W、Q在元素周期表中的位置如表所示,Y、Q的原子序数之和是X的4倍。回答下列问题:
(1)写出P元素简单氢化物和其最高价氧化物的水化物反应的化学方程式___________ 。
(2)葡萄酒中添加适量的某种Q的氧化物,可以起到杀菌的作用,同时利用其的___________ 性防止葡萄酒被氧化。
(3)X与Y按原子数之比为1:2形成化合物的电子式为___________ ,Y与Z形成的一种化合物是淡黄色固体,该化合物中所含化学键的类型是___________ 。
Ⅱ.汽车尾气(含碳氢化合物、CO、SO2与NO等物质)是城市空气的污染源之一、治理的方法之一是在汽车的排气管上装一个催化转化器(用Pt、Pd合金作催化剂),它的特点是使CO与NO反应,生成可参与大气循环的无毒气体,并促使汽油充分燃烧及SO2的转化。
(4)写出在催化剂的作用下CO与NO反应的化学方程式:___________ 。
(5)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是___________ 。
(6)控制城市空气污染源的方法有___________(填字母)。
| X | P | Y |
| W | Q |
(2)葡萄酒中添加适量的某种Q的氧化物,可以起到杀菌的作用,同时利用其的
(3)X与Y按原子数之比为1:2形成化合物的电子式为
Ⅱ.汽车尾气(含碳氢化合物、CO、SO2与NO等物质)是城市空气的污染源之一、治理的方法之一是在汽车的排气管上装一个催化转化器(用Pt、Pd合金作催化剂),它的特点是使CO与NO反应,生成可参与大气循环的无毒气体,并促使汽油充分燃烧及SO2的转化。
(4)写出在催化剂的作用下CO与NO反应的化学方程式:
(5)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是
(6)控制城市空气污染源的方法有___________(填字母)。
| A.植树造林 | B.开发氢能源 | C.使用电动车 | D.使用无铅汽油 |
您最近一年使用:0次
名校
解题方法
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
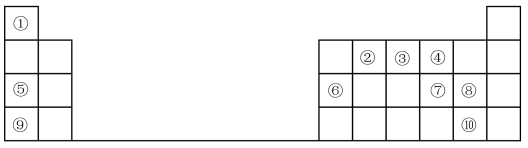
(1)元素②在周期表中的位置___________
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是___________ (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:___________ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是___________ (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:___________ 。
(6)元素的非金属性⑩___________ ⑧(填“>”或“<”);下列事实不能 证明上述结论的是___________ 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱

(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:
(6)元素的非金属性⑩
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
您最近一年使用:0次
2024-02-13更新
|
146次组卷
|
2卷引用:天津市重点校2023-2024学年高一上学期期末联考化学试题
名校
解题方法
9 . 下表列出了①~⑪11种元素在元素周期表中的位置:
(1)写出元素③形成单质的电子式___________ ②的最高价氧化物的结构式为___________ ;⑩的最高价氧化物的水化物的化学式为___________ 。
(2)画这11种元素中,非金属性最强的元素的原子结构示意图___________ 。
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式___________ 。
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因___________ 。
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为___________ 。
②下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑪ |
(2)画这11种元素中,非金属性最强的元素的原子结构示意图
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为
②下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系
您最近一年使用:0次
2024-01-21更新
|
81次组卷
|
2卷引用:浙江省宁波市效实中学2023-2024学年高一上学期期末化学模拟卷
名校
10 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是___________ (填化学式)。
(2)d与f能形成一种淡黄色的物质,其电子式为___________ 。
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)由a的单质制成的电池需要注意防水,其原因为___________ (用化学方程式表示)。
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为___________ 。预测g与Ga的最高价氧化物对应水化物的碱性较强的是___________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液

请选择装置丙、丁两处应该加入的药品代号:丙___________ 、丁___________ 。
(7)某实验小组向100mL 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。

从开始通入 到
到 时,溶液中
时,溶液中
___________ 。

(1)c、d、e、i四种元素的最简单氢化物中,最稳定的是
(2)d与f能形成一种淡黄色的物质,其电子式为
(3)g的最高价氧化物对应的水化物与f的最高价氧化物对应的水化物反应的离子方程式为
(4)由a的单质制成的电池需要注意防水,其原因为
(5)门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为g的下一周期存在一种“类g”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
(6)使用下列装置再添加合适的药品,可以证明b和h两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液
请选择装置丙、丁两处应该加入的药品代号:丙
(7)某实验小组向100mL
 溶液中通入气体单质
溶液中通入气体单质 ,溶液中
,溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。
从开始通入
 到
到 时,溶液中
时,溶液中
您最近一年使用:0次
2024-01-15更新
|
135次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题



