名校
1 . 肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________ L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________ 。
②实验中加热煮沸的目的是___________ 。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
⑴生产1000 g质量分数为25.6%的肼溶液最少需要
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。①用H2O2与次氯酸钠反应的离子方程式为
②实验中加热煮沸的目的是
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。
您最近一年使用:0次
2017-04-16更新
|
616次组卷
|
4卷引用:2017届江苏省南通市高三第一次模拟考试化学试卷
解题方法
2 . I.水中溶解氧气的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,反应方程式为2S2O +I2=S4O
+I2=S4O +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 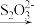 S4O
S4O 。
。
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________ 。
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为_________ mg·L-1。
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为________ mol/L(保留一位小数),需用量筒量取30%的双氧水_________ mL。
(2)该实验在酸性条件下进行,则实验设计的反应原理是_____________ (用离子方程式表示)。
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为_________ (用含a、b的式子表示)。
 +I2=S4O
+I2=S4O +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 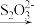 S4O
S4O 。
。(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为
(2)该实验在酸性条件下进行,则实验设计的反应原理是
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为
您最近一年使用:0次
名校
3 . 请写出简单的计算过程。
(1)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2 体积为1.344 L(标准状况),则钴氧化物的化学式为_____________ 。
(2)将一定量Fe、FeO 和 Fe2O3 的混合物放入25 mL 2 mol·L-1 的HNO3溶液中,反应完全后,无固体剩余,生成 224 mL NO 气体(标准状况),再向反应后的溶液中加入1mol·L-1 的 NaOH 溶液,要使铁元素全部沉淀下来,所加 NaOH 溶液的体积最少是__________________ 。
(3)取Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300molFeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为________________ 。(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208)。
(1)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2 体积为1.344 L(标准状况),则钴氧化物的化学式为
(2)将一定量Fe、FeO 和 Fe2O3 的混合物放入25 mL 2 mol·L-1 的HNO3溶液中,反应完全后,无固体剩余,生成 224 mL NO 气体(标准状况),再向反应后的溶液中加入1mol·L-1 的 NaOH 溶液,要使铁元素全部沉淀下来,所加 NaOH 溶液的体积最少是
(3)取Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300molFeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
解题方法
4 . 将5.60 g纯铁粉加入适量稀硫酸中,固体完全溶解。加热条件下向反应液中先加入1.7 g NaNO3固体(已知NO3-在酸性条件下具有强氧化性),再通入448 mL Cl2(标准状况下,假设Cl2不逸出),产物中铁元素全部以Fe3+存在。(要求简要写出计算过程)
(1)被氯气氧化的Fe2+物质的量为________ 。
(2)NaNO3对应的还原产物中氮元素的化合价是________ 。
(1)被氯气氧化的Fe2+物质的量为
(2)NaNO3对应的还原产物中氮元素的化合价是
您最近一年使用:0次
2013·上海闵行·三模
5 . 钠及其化合物在生产和生活中有广泛的应用。例如:Na2O2在医院、潜水、高空飞行中用作供氧剂。
(1)制备Na2O2的反应为:4Na+O2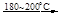 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。
①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为_________ 。
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为______________ 。
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有__________________________________ 。
②若2a=c,则M气体可能是什么气体?通过计算回答______ 。
(1)制备Na2O2的反应为:4Na+O2
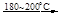 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有
②若2a=c,则M气体可能是什么气体?通过计算回答
您最近一年使用:0次
2022高三·全国·专题练习
6 . 现有m g某气体(双原子分子),其摩尔质量为M g·mol-1,若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为___________ mol。
(2)该气体所含原子总数为___________ 。
(3)该气体在标准状况下的体积为___________ L。
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
(1)该气体的物质的量为
(2)该气体所含原子总数为
(3)该气体在标准状况下的体积为
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2
 2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
解题方法
7 . (1)加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是_______ 。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________ 。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中 含氧气8 g/L的溶解氧,需要肼的质量为
含氧气8 g/L的溶解氧,需要肼的质量为__________ 。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中
 含氧气8 g/L的溶解氧,需要肼的质量为
含氧气8 g/L的溶解氧,需要肼的质量为
您最近一年使用:0次
8 . 过氧乙酸(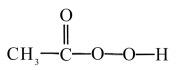 )可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
)可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
(1)过氧乙酸极不稳定,110℃时遇空气发生爆炸,此时发生反应的化学方程式是__________ ,所以过氧乙酸需要___________ 保存。
(2)过氧乙酸具有强氧化性,这与它的( )
)________ (填序号)键有关,向硫酸酸化的过氧乙酸溶液中加入少量KI溶液,溶液变黄,发生反应的离子方程式是_________ ,如有 过氧乙酸被还原,转移电子的物质的量是
过氧乙酸被还原,转移电子的物质的量是___________ mol。
(3)过氧乙酸可由 与
与 ,在浓硫酸催化作用下制得,反应方程式是
,在浓硫酸催化作用下制得,反应方程式是_________ ,其中浓硫酸用量(浓硫酸占反应液的体积百分数)对过氧乙酸的含量的影响如图:
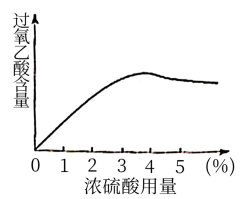
根据图表分析,浓硫酸的合适用量为___________ %(填整数)。
(4)过氧乙酸也可以用乙醛氧化法制得,反应原理为:
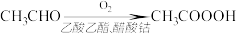
反应中乙醛的转化率为85%,生产质量分数10%的过氧乙酸溶液100kg,需要乙醛的质量为________ kg。
 )可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
)可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。(1)过氧乙酸极不稳定,110℃时遇空气发生爆炸,此时发生反应的化学方程式是
(2)过氧乙酸具有强氧化性,这与它的(
 )
) 过氧乙酸被还原,转移电子的物质的量是
过氧乙酸被还原,转移电子的物质的量是(3)过氧乙酸可由
 与
与 ,在浓硫酸催化作用下制得,反应方程式是
,在浓硫酸催化作用下制得,反应方程式是
根据图表分析,浓硫酸的合适用量为
(4)过氧乙酸也可以用乙醛氧化法制得,反应原理为:
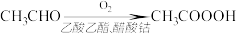
反应中乙醛的转化率为85%,生产质量分数10%的过氧乙酸溶液100kg,需要乙醛的质量为
您最近一年使用:0次
解题方法
9 . 水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
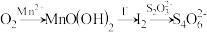
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________ 。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L−1 Na2S2O3标准溶液13.50 mL。(已知反应:I2+2S2O32-=2I-+S4O62-)计算该水样中的溶解氧(以mg·L−1表示),写出计算过程__________ 。
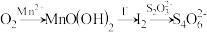
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L−1 Na2S2O3标准溶液13.50 mL。(已知反应:I2+2S2O32-=2I-+S4O62-)计算该水样中的溶解氧(以mg·L−1表示),写出计算过程
您最近一年使用:0次
解题方法
10 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___ 。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___ ?
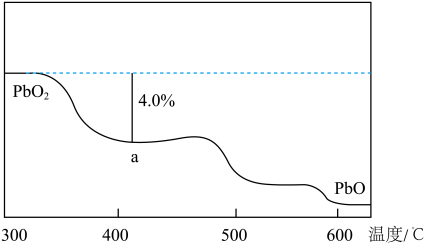
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___ 、___ 。
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值

您最近一年使用:0次



