2023高三·全国·专题练习
1 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤2,产品中 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的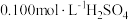 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为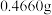 。
。
产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤2,产品中
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
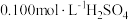 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为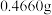 。
。产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
3 . 已知CaO2在350 ℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
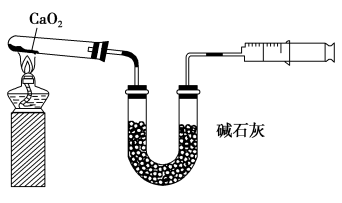
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为___________ (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有___________ 。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为
您最近一年使用:0次
4 . 过氧乙酸(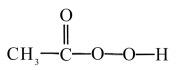 )可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
)可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
(1)过氧乙酸极不稳定,110℃时遇空气发生爆炸,此时发生反应的化学方程式是__________ ,所以过氧乙酸需要___________ 保存。
(2)过氧乙酸具有强氧化性,这与它的( )
)________ (填序号)键有关,向硫酸酸化的过氧乙酸溶液中加入少量KI溶液,溶液变黄,发生反应的离子方程式是_________ ,如有 过氧乙酸被还原,转移电子的物质的量是
过氧乙酸被还原,转移电子的物质的量是___________ mol。
(3)过氧乙酸可由 与
与 ,在浓硫酸催化作用下制得,反应方程式是
,在浓硫酸催化作用下制得,反应方程式是_________ ,其中浓硫酸用量(浓硫酸占反应液的体积百分数)对过氧乙酸的含量的影响如图:
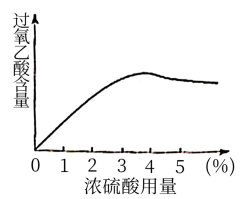
根据图表分析,浓硫酸的合适用量为___________ %(填整数)。
(4)过氧乙酸也可以用乙醛氧化法制得,反应原理为:
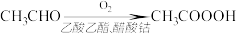
反应中乙醛的转化率为85%,生产质量分数10%的过氧乙酸溶液100kg,需要乙醛的质量为________ kg。
 )可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
)可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。(1)过氧乙酸极不稳定,110℃时遇空气发生爆炸,此时发生反应的化学方程式是
(2)过氧乙酸具有强氧化性,这与它的(
 )
) 过氧乙酸被还原,转移电子的物质的量是
过氧乙酸被还原,转移电子的物质的量是(3)过氧乙酸可由
 与
与 ,在浓硫酸催化作用下制得,反应方程式是
,在浓硫酸催化作用下制得,反应方程式是
根据图表分析,浓硫酸的合适用量为
(4)过氧乙酸也可以用乙醛氧化法制得,反应原理为:
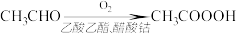
反应中乙醛的转化率为85%,生产质量分数10%的过氧乙酸溶液100kg,需要乙醛的质量为
您最近一年使用:0次
2020高三·全国·专题练习
5 . (1)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________ 。(计算结果保留两位小数)
(2)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应。假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3________ kg。
(3)NaCN超标的电镀废水可用两段氧化法处理:NaCN与NaClO反应,生成NaOCN和NaCl,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。处理100m3含NaCN 10.3mg/L的废水,实际至少需NaClO________ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。
(2)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应。假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3
(3)NaCN超标的电镀废水可用两段氧化法处理:NaCN与NaClO反应,生成NaOCN和NaCl,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。处理100m3含NaCN 10.3mg/L的废水,实际至少需NaClO
您最近一年使用:0次
2020高三·全国·专题练习
6 . (1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值_______ (列出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-=CuY2-+ 2H+,写出计算CuSO4·5H2O质量分数的表达式ω=______ 。
(3)硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g。③准确量取25.00 mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2 +5H2O2+6H+=4Mn2++8H2O+5O2↑,通过计算确定样品的组成
+5H2O2+6H+=4Mn2++8H2O+5O2↑,通过计算确定样品的组成______ (写出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-=CuY2-+ 2H+,写出计算CuSO4·5H2O质量分数的表达式ω=
(3)硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g。③准确量取25.00 mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2
 +5H2O2+6H+=4Mn2++8H2O+5O2↑,通过计算确定样品的组成
+5H2O2+6H+=4Mn2++8H2O+5O2↑,通过计算确定样品的组成
您最近一年使用:0次
名校
解题方法
7 . 为测定 K2[Cu(C2O4)2]·2H2O(M=354g/mol)含量,准确称取试样1.000g溶于 NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,重复试验,平均消耗 KMnO4标准液20.00mL。已知:C2O42-酸性条件下被MnO4-氧化为CO2,杂质不参加反应。该样品中K2[Cu(C2O4)2]·2H2O的质量分数为____________ (保留小数点后两位) ,写出简要计算过程:__________________ 。
您最近一年使用:0次
2013·上海闵行·二模
8 . 开展“三废”综合治理,是防治工业“三废”污染,搞好环境保护的重要途径之一。其中常用方法是将“三废”中有毒有害物转化为无害的物质或有用的产品。
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理:4NO + 4NH3 + O2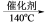 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3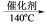 7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为_______ (精确到0.01)。
②尾气中NO的含量为_______ mg/m3。
③要处理5m3的尾气,需要氨氧混合气的体积为_______ L。
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收。
①NaOH溶液的物质的量浓度为_______ mol/L,体积为__________ mL。
②已知反应后溶液中含有0.35mol NaNO2。若将尾气中NO与NO2的平均组成记为NOx,则x=_________ 。
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4·2H2O)。已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗)。_____________
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理:4NO + 4NH3 + O2
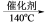 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3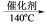 7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。①氨氧混合气的平均相对分子质量为
②尾气中NO的含量为
③要处理5m3的尾气,需要氨氧混合气的体积为
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收。
①NaOH溶液的物质的量浓度为
②已知反应后溶液中含有0.35mol NaNO2。若将尾气中NO与NO2的平均组成记为NOx,则x=
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4·2H2O)。已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗)。
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
9 . 水泥是重要的建筑材料,水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙的含量:先将水泥转变为草酸钙,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2↑+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L−1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________ 。
您最近一年使用:0次
10 . 天然气在生活、生产中应用越来越广泛,如成为居民日常燃料,成为工业合成氨原料等。由天然气制取合成氨原料其主要反应为:
CH4(g)+H2O(g)→CO(g)+3H2(g) ①
2CH4(g)+O2(g)→2CO(g)+4H2(g) ②
CO(g)+H2O(g)→CO2(g)+H2(g) ③
(1)1m3(标准状况)CH4按②式完全反应,产生H2_______ mol。(保留一位小数)
(2)一定量的CH4、空气、水蒸气反应后得到某混合气体,各成分的质量分数分别是为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,此混合气体对氢气的相对密度是______________ (保留一位小数)
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应后,得到的气体组成如下表:
列式计算该富氧空气中O2和N2的体积比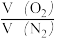 =
=____________ 。反应中的CH4、H2O(g)和富氧空气的体积比=___________ 。
(4)某课外活动小组探究CH4和纯氧的反应,取CH4和纯氧组成的混合气体a mol通入装有9.36g Na2O2固体的密闭容器中,用电火花不断引燃,使之高温下充分反应,恢复至常温时,容器内压强几乎为零。剩余固体成分与a的取值及CH4与O2的体积比值n之间有很多种情况,试帮助该小组同学填写如下几种情况。
CH4(g)+H2O(g)→CO(g)+3H2(g) ①
2CH4(g)+O2(g)→2CO(g)+4H2(g) ②
CO(g)+H2O(g)→CO2(g)+H2(g) ③
(1)1m3(标准状况)CH4按②式完全反应,产生H2
(2)一定量的CH4、空气、水蒸气反应后得到某混合气体,各成分的质量分数分别是为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,此混合气体对氢气的相对密度是
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应后,得到的气体组成如下表:
| 气体 | CO | H2 | N2 | O2 | CO2 |
| 体积(L) | 15 | 70 | 20 | 4.5 | 10 |
列式计算该富氧空气中O2和N2的体积比
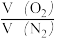 =
=(4)某课外活动小组探究CH4和纯氧的反应,取CH4和纯氧组成的混合气体a mol通入装有9.36g Na2O2固体的密闭容器中,用电火花不断引燃,使之高温下充分反应,恢复至常温时,容器内压强几乎为零。剩余固体成分与a的取值及CH4与O2的体积比值n之间有很多种情况,试帮助该小组同学填写如下几种情况。
| a取值 | n=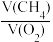 | 剩余固体 |
| Na2CO3,NaOH,Na2O2 | ||
| Na2CO3,NaOH | ||
| Na2CO3,NaOH | ||
| Na2CO3 |
您最近一年使用:0次



