名校
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
2022-07-29更新
|
1154次组卷
|
3卷引用:浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题
浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
2 . 氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________ 。
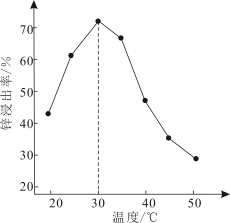
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________ 。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________ 。
(4)“滤渣3”除锌外,主要成分为___________________ 。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________ (写名称)。电解后的电解液经补充_________ (写一种物质的化学式)后可返回至__________________ (填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________ 。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为

(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式
(4)“滤渣3”除锌外,主要成分为
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为
您最近一年使用:0次
3 . X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):

(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:_____
②如何设计实验检验Z中阳离子:_____
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:_____
②写出Z与Cu反应的化学方程式_____

(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:
②如何设计实验检验Z中阳离子:
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:
②写出Z与Cu反应的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 下表列出了①~⑪11种元素在元素周期表中的位置:
(1)写出元素③形成单质的电子式___________ ②的最高价氧化物的结构式为___________ ;⑩的最高价氧化物的水化物的化学式为___________ 。
(2)画这11种元素中,非金属性最强的元素的原子结构示意图___________ 。
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式___________ 。
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因___________ 。
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为___________ 。
②下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑪ |
(2)画这11种元素中,非金属性最强的元素的原子结构示意图
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为
②下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系
您最近一年使用:0次
2024-01-21更新
|
86次组卷
|
2卷引用:浙江省宁波市效实中学2023-2024学年高一上学期期末化学模拟卷
解题方法
5 . 下图是部分短周期主族元素原子半径与原子序数的关系。
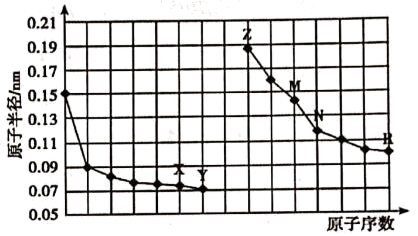
(1)X元素在元素周期表中的位置:___________ 。
(2)Y与Z形成的是___________ 化合物。(填“离子”或“共价”)
(3)上述元素中,最高价氧化物的水化物碱性最强的是___________ (填化学式)。
(4)下列关于元素及其化合物性质的判断中,正确的是___________ (填序号)
A.元素Z最外层只有1个电子,而M最外层有3个电子,所以金属性:
B.可通过Z与W的单质与水反应的剧烈程度的实验,判断金属性
C.Z、M、R三种元素的简单离子半径的大小: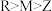
D.X、Y两种元素的气态氢化物的稳定性:
(5)某小组为证明N和R的非金属性强弱,设计实验方案如下,取N的最高价含氧酸正盐溶液,滴加含R的某溶液,通过观察实验现象来证明,其化学方程式为___________ 。

(1)X元素在元素周期表中的位置:
(2)Y与Z形成的是
(3)上述元素中,最高价氧化物的水化物碱性最强的是
(4)下列关于元素及其化合物性质的判断中,正确的是
A.元素Z最外层只有1个电子,而M最外层有3个电子,所以金属性:

B.可通过Z与W的单质与水反应的剧烈程度的实验,判断金属性

C.Z、M、R三种元素的简单离子半径的大小:
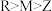
D.X、Y两种元素的气态氢化物的稳定性:

(5)某小组为证明N和R的非金属性强弱,设计实验方案如下,取N的最高价含氧酸正盐溶液,滴加含R的某溶液,通过观察实验现象来证明,其化学方程式为
您最近一年使用:0次
解题方法
6 . 随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
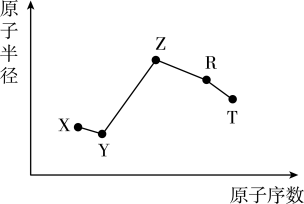
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___ 。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___ 。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____ 。
(4)工业上以Z3RY6作助熔剂的目的是____ 。

已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为
(3)请用一个化学方程式比较X和Y的非金属性的强弱
(4)工业上以Z3RY6作助熔剂的目的是
您最近一年使用:0次
名校
解题方法
7 . 元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:

(1)元素F在周期表中的位置是_____________ 。
(2)元素C、D、E原子半径由大到小的顺序是___________ (填元素符号)。
(3)A、B、C的单质与氢气反应的难易程度由易到难的顺序____________ (用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______ (写 2种)。
(5)D在B单质中燃烧生成的物质电子式为__________ ;氢原子与 B原子以1:1结合的物质结构式为___________ 。
(6)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应________ (填“能”或“不能"),若能则写出反应的化学方程式_______________ 。

(1)元素F在周期表中的位置是
(2)元素C、D、E原子半径由大到小的顺序是
(3)A、B、C的单质与氢气反应的难易程度由易到难的顺序
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式
(5)D在B单质中燃烧生成的物质电子式为
(6)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应
您最近一年使用:0次
名校
8 . 元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
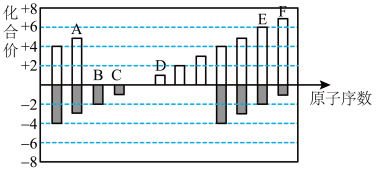
(1)元素F在周期表中的位置是______ 。
(2)元素C、D、E原子半径由大到小的顺序是______ (填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____ (用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______ 、__ (写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应_____ (填“能”或“不能”), 若能则写出反应的化学方程式 ______ 。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ⇌2AB2(g)。可以作为达到平衡状态的标志是______ 。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变

(1)元素F在周期表中的位置是
(2)元素C、D、E原子半径由大到小的顺序是
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ⇌2AB2(g)。可以作为达到平衡状态的标志是
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
您最近一年使用:0次
2019-06-29更新
|
603次组卷
|
3卷引用:浙江省嘉兴市2018-2019学年高一下学期期末考试化学试题
9 . 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题:

(1)A在元素周期表中的位置 。
B的最高价氧化物化学式为 。
写出C元素气态氢化物的电子式 。
(2)D的单质与水反应的化学方程式为_ 。
(3)五种元素中原子半径最小的是______(填元素符号),这些元素的最高价氧化物的对应水化物中________酸性最强。
(4)C的一种氧化物是常见的大气污染物。为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4·2H2O)。假设在转化过程中C元素不损失,每天处理1120 m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏(请写出计算过程)。

(1)A在元素周期表中的位置 。
B的最高价氧化物化学式为 。
写出C元素气态氢化物的电子式 。
(2)D的单质与水反应的化学方程式为_ 。
(3)五种元素中原子半径最小的是______(填元素符号),这些元素的最高价氧化物的对应水化物中________酸性最强。
(4)C的一种氧化物是常见的大气污染物。为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4·2H2O)。假设在转化过程中C元素不损失,每天处理1120 m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏(请写出计算过程)。
您最近一年使用:0次
10 . 已知甲、乙、丙、丁是四种常见物质,其转化关系如图所示。
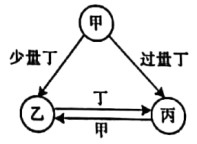
请回答下列问题:
(1)若丁为O2,乙常温下为淡黄色单质固体。写出乙中所含元素在周期表中的位置__ ,甲的分子式___ 。
(2)若丙和丁均为金属单质,且丙为我国目前生产量最大,使用最广泛的金属,甲和乙均为盐溶液。比较丙和丁还原性强弱:丙___ 丁(写>、<、=),甲跟丙反应生成乙的离子方程式__ 。
(3)若甲、乙、丙的水溶液均呈碱性且丙可制胃药。写出甲和丙反应生成乙的化学方程式__ 。

请回答下列问题:
(1)若丁为O2,乙常温下为淡黄色单质固体。写出乙中所含元素在周期表中的位置
(2)若丙和丁均为金属单质,且丙为我国目前生产量最大,使用最广泛的金属,甲和乙均为盐溶液。比较丙和丁还原性强弱:丙
(3)若甲、乙、丙的水溶液均呈碱性且丙可制胃药。写出甲和丙反应生成乙的化学方程式
您最近一年使用:0次



