名校
解题方法
1 . 下列说法正确的有
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次
2021-12-03更新
|
348次组卷
|
2卷引用:江西省丰城中学2022-2023学年高一上学期期中考试化学试题(创新班)
名校
2 . 下列实验设计可以达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 证明金属活动性: | 将金属钠投入 溶液中 溶液中 |
| B | 检验待测液中含有 | 用玻璃棒蘸取待测液在无色火焰上灼烧,观察现象 |
| C | 制备 胶体 胶体 | 将5~6滴饱和 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 |
| D | 探究钠在空气中燃烧产物为 | 将燃烧后的物质置于水中,滴入无色酚酞溶液,一段时间后,溶液为红色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-20更新
|
450次组卷
|
4卷引用:江西省赣州教育发展联盟2022-2023学年高一上学期12月月考化学试题
解题方法
3 . Liepatoff规则:胶核总选择性吸附与其本身组成相似的离子形成胶粒。例如, 溶于水形成胶体粒子,
溶于水形成胶体粒子, 胶核选择性吸附
胶核选择性吸附 形成胶粒并带正电荷。下列叙述正确的是
形成胶粒并带正电荷。下列叙述正确的是

 溶于水形成胶体粒子,
溶于水形成胶体粒子, 胶核选择性吸附
胶核选择性吸附 形成胶粒并带正电荷。下列叙述正确的是
形成胶粒并带正电荷。下列叙述正确的是
| A.氢氧化铁胶体可用于饮用水消毒和净化 |
| B.丁达尔现象能证明氢氧化铁胶粒带电荷 |
C. 溶胶中吸附的阳离子总数大于阴离子总数 溶胶中吸附的阳离子总数大于阴离子总数 |
D.利用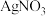 和 和 制 制 胶体,若 胶体,若 过量,则胶粒带负电荷 过量,则胶粒带负电荷 |
您最近一年使用:0次
4 . 硝酸是中学常见的试剂,广泛应用于化学实验。
实验Ⅰ:探究元素性质递变规律。
某小组选择硝酸、碳酸钙和硅酸钠溶液,证明N、C、Si的非金属性依次减弱。

(1)B中试剂是_______ 。
(2)写出A中离子方程式:_______ 。
(3)C中可能的实验现象是_______ ,由此证明碳的非金属性比硅强。
(4)有同学采用替代试剂的方法,利用上述装置证明氯的非金属性比硫强,他选择的试剂是盐酸、亚硫酸钠粉末、品红溶液,他不能达到实验目的,原因是_______ 。
实验Ⅱ:探究铜与硝酸反应速率。
小组乙设计如下方案:
(5)实验测得b<a,可以得出实验结论是_______ 。
(6)设计实验②和④的目的是_______ 。上述实验方案,不能探究_______ (填字母)对铜和硝酸反应速率的影响。
A.温度 B.浓度 C.接触面 D.催化剂
实验Ⅰ:探究元素性质递变规律。
某小组选择硝酸、碳酸钙和硅酸钠溶液,证明N、C、Si的非金属性依次减弱。

(1)B中试剂是
(2)写出A中离子方程式:
(3)C中可能的实验现象是
(4)有同学采用替代试剂的方法,利用上述装置证明氯的非金属性比硫强,他选择的试剂是盐酸、亚硫酸钠粉末、品红溶液,他不能达到实验目的,原因是
实验Ⅱ:探究铜与硝酸反应速率。
小组乙设计如下方案:
| 实验 | 2g铜 | 10mL硝酸 | 温度/℃ | 铜完全溶解的时间/min |
| ① | 铜片 | 2mol/L | 20 | a |
| ② | 铜片 | 4mol/L | 20 | b |
| ③ | 铜粉 | 4mol/L | 20 | c |
| ④ | 铜片 | 4mol/L | 40 | d |
(6)设计实验②和④的目的是
A.温度 B.浓度 C.接触面 D.催化剂
您最近一年使用:0次
5 . 锡是活泼金属,四氯化锡(SnCl4)是重要的媒染剂,易与水反应,熔点为-33℃、沸点为114℃。某研究性学习小组设计如图所示装置(部分夹持装置省略,MnO2过量)制备SnCl4。

请回答下列问题:
(1)SnCl4属于___________ (填字母)。
A.酸 B.碱 C.盐
(2)B中试剂是___________ (填名称)。
(3)写出A中反应的离子方程式:___________ 。在该反应中,作还原剂的HCl和表现酸性的HCl的物质的量之比为___________ 。
(4)氯气与锡反应类型是___________ (填基本反应类型)。
(5)该实验装置设计尚存在缺陷。改进的方法是在装置F后应连接一个装有___________ 填名称)的干燥管(或U形管)。
(6)实验完毕后,取少量SnCl4溶于蒸馏水,得到一种液体M,请设计简单实验证明M是否是胶体:___________ 。

请回答下列问题:
(1)SnCl4属于
A.酸 B.碱 C.盐
(2)B中试剂是
(3)写出A中反应的离子方程式:
(4)氯气与锡反应类型是
(5)该实验装置设计尚存在缺陷。改进的方法是在装置F后应连接一个装有
(6)实验完毕后,取少量SnCl4溶于蒸馏水,得到一种液体M,请设计简单实验证明M是否是胶体:
您最近一年使用:0次
解题方法
6 . I. 为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B原子的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物
为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B原子的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物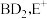 与
与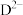 具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)G在元素周期表中的位置是_______ 。
(2)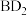 的电子式为
的电子式为_______ ;
(3) 分别形成的简单离子的半径由大到小的顺序为
分别形成的简单离子的半径由大到小的顺序为_______ (用离子符号表示);
(4)由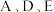 三种元素组成的化合物含有的化学键类型为
三种元素组成的化合物含有的化学键类型为_______ ;
(5)设计一个简单的实验证明G和B的非金属性强弱:_______ (用化学方程式表示)。
Ⅱ、人体血液里 的浓度一般采用
的浓度一般采用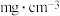 来表示。抽取一定体积的血样,加适量的草酸铵
来表示。抽取一定体积的血样,加适量的草酸铵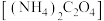 溶液,可析出草酸钙
溶液,可析出草酸钙 沉淀:
沉淀: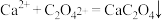 。将此草酸钙沉淀洗涤后溶于强酸可得草酸
。将此草酸钙沉淀洗涤后溶于强酸可得草酸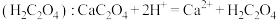 ,再用酸性
,再用酸性 溶液滴定即可测定血液样品中
溶液滴定即可测定血液样品中 的浓度。取血液样品
的浓度。取血液样品 ,经过上述处理后得到草酸,再加入
,经过上述处理后得到草酸,再加入 酸性
酸性 溶液滴定使草酸全部转化成
溶液滴定使草酸全部转化成 逸出,这时共消耗
逸出,这时共消耗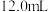 酸性
酸性 溶液。已知草酸与酸性
溶液。已知草酸与酸性 溶液反应的离子方程式为:
溶液反应的离子方程式为: (未配平)
(未配平)
(6)请将该离子方程式配平:_______ 。


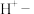



(7)经过计算,血液样品中 的浓度为
的浓度为_______ 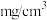 。
。
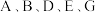 为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B原子的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物
为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B原子的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物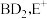 与
与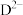 具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)G在元素周期表中的位置是
(2)
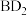 的电子式为
的电子式为(3)
 分别形成的简单离子的半径由大到小的顺序为
分别形成的简单离子的半径由大到小的顺序为(4)由
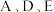 三种元素组成的化合物含有的化学键类型为
三种元素组成的化合物含有的化学键类型为(5)设计一个简单的实验证明G和B的非金属性强弱:
Ⅱ、人体血液里
 的浓度一般采用
的浓度一般采用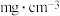 来表示。抽取一定体积的血样,加适量的草酸铵
来表示。抽取一定体积的血样,加适量的草酸铵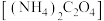 溶液,可析出草酸钙
溶液,可析出草酸钙 沉淀:
沉淀: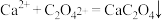 。将此草酸钙沉淀洗涤后溶于强酸可得草酸
。将此草酸钙沉淀洗涤后溶于强酸可得草酸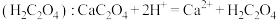 ,再用酸性
,再用酸性 溶液滴定即可测定血液样品中
溶液滴定即可测定血液样品中 的浓度。取血液样品
的浓度。取血液样品 ,经过上述处理后得到草酸,再加入
,经过上述处理后得到草酸,再加入 酸性
酸性 溶液滴定使草酸全部转化成
溶液滴定使草酸全部转化成 逸出,这时共消耗
逸出,这时共消耗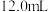 酸性
酸性 溶液。已知草酸与酸性
溶液。已知草酸与酸性 溶液反应的离子方程式为:
溶液反应的离子方程式为: (未配平)
(未配平)(6)请将该离子方程式配平:


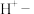



(7)经过计算,血液样品中
 的浓度为
的浓度为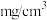 。
。
您最近一年使用:0次
2022-01-22更新
|
131次组卷
|
2卷引用:江西省新余市2021-2022学年高一上学期期末考试化学试题
7 . 铁的化合物在生活中有非常重要的作用。
(1)写出上 溶液腐蚀覆铜板来制作印刷电路板的化学方程式:
溶液腐蚀覆铜板来制作印刷电路板的化学方程式:___________
(2)向沸水中逐滴加入5-6滴,继续煮沸至液体呈红褐色,停止加热制得 胶体,可利用
胶体,可利用___________ 来区分 胶体和
胶体和 饱和溶液。
饱和溶液。
(3)我国正在推行垃圾分类,为研究旧物的再利用,实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体(FeSO4∙7H2O),流程如下;

①试剂X是将铁及其铁表面的氧化物溶解,则实际X最好是___________
A.稀盐酸 B.稀硫酸 C.稀硝酸
②要想证明酸溶后的溶液中存在Fe3+,应取少量酸溶后溶液于试管中滴加_______ ,产生的现象为:________ 。
③写出还原反应的离子方程式_________ 。
④也可以用废铁屑制备氯化铁,则在选择合适的酸进行酸溶后应加________ (填字母)。
A.氧化剂 B.还原剂
(1)写出上
 溶液腐蚀覆铜板来制作印刷电路板的化学方程式:
溶液腐蚀覆铜板来制作印刷电路板的化学方程式:(2)向沸水中逐滴加入5-6滴,继续煮沸至液体呈红褐色,停止加热制得
 胶体,可利用
胶体,可利用 胶体和
胶体和 饱和溶液。
饱和溶液。(3)我国正在推行垃圾分类,为研究旧物的再利用,实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体(FeSO4∙7H2O),流程如下;

①试剂X是将铁及其铁表面的氧化物溶解,则实际X最好是
A.稀盐酸 B.稀硫酸 C.稀硝酸
②要想证明酸溶后的溶液中存在Fe3+,应取少量酸溶后溶液于试管中滴加
③写出还原反应的离子方程式
④也可以用废铁屑制备氯化铁,则在选择合适的酸进行酸溶后应加
A.氧化剂 B.还原剂
您最近一年使用:0次
名校
8 . 下列实验过程可以达到实验目的的是
| 选项 | 实验操作和现象 | 实验目的 |
| A | 盐酸滴入硅酸钠溶液中出现白色沉淀 | 证明非金属性: |
| B | 向碳酸钙固体中加入盐酸,将生成的气体依次通过饱和碳酸钠溶液、浓硫酸 | 制取并纯化 |
| C | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液(无色),观察颜色变化 | 探究维生素C的还原性 |
| D | 向 支盛有 支盛有 溶液的试管中分别加入 溶液的试管中分别加入 溶液和 溶液和 溶液,观察到加入 溶液,观察到加入 溶液的 溶液的 分解速率更快 分解速率更快 | 证明 对 对 分解的催化效果比 分解的催化效果比 的效果好 的效果好 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-05-07更新
|
419次组卷
|
6卷引用:江西省萍乡市萍乡实验学校2021-2022学年高一下学期第二次调研考试化学试题
名校
解题方法
9 . 治疗胃病药物M的化学式为 ,为探究M的具体组成,对M按下列流程进行相关实验,测得有关数据如图所示(气体体积已折算成标准状况)。下列说法不正确的是
,为探究M的具体组成,对M按下列流程进行相关实验,测得有关数据如图所示(气体体积已折算成标准状况)。下列说法不正确的是

 ,为探究M的具体组成,对M按下列流程进行相关实验,测得有关数据如图所示(气体体积已折算成标准状况)。下列说法不正确的是
,为探究M的具体组成,对M按下列流程进行相关实验,测得有关数据如图所示(气体体积已折算成标准状况)。下列说法不正确的是
A.混合气A中 |
| B.“操作Ⅰ”中用到的玻璃仪器有烧杯、玻璃棒和漏斗 |
C.M中 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
D.化合物M的化学式为 |
您最近一年使用:0次
解题方法
10 . 硫酸铁铵[NH4Fe(SO4)2•xH2O]是一种重要的铁盐,为充分利用资源,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:

回答下列问题:
(1)NH4Fe(SO4)2•xH2O中铁元素的化合价为____ 价。
(2)步骤②的操作名称为____ ,主要用到的玻璃仪器有烧杯、漏斗和玻璃棒,其中玻璃棒的作用为____ 。
(3)下列有关固体硫酸铵的说法正确的是____ (填标号)。
A.从物质的组成来看,硫酸铵属于氧化物
B.0.1mol硫酸铵中所含的氮元素的总质量为2.8g
C.固体硫酸铵不能导电,但其属于电解质
(4)步骤③中通入O2的目的是将Fe2+全部转化为Fe3+,请写出反应的离子方程式:____ ,该反应中,每转移0.2mol电子,此时消耗O2的体积为____ L(标准状况下)。

回答下列问题:
(1)NH4Fe(SO4)2•xH2O中铁元素的化合价为
(2)步骤②的操作名称为
(3)下列有关固体硫酸铵的说法正确的是
A.从物质的组成来看,硫酸铵属于氧化物
B.0.1mol硫酸铵中所含的氮元素的总质量为2.8g
C.固体硫酸铵不能导电,但其属于电解质
(4)步骤③中通入O2的目的是将Fe2+全部转化为Fe3+,请写出反应的离子方程式:
您最近一年使用:0次
2022-12-08更新
|
121次组卷
|
2卷引用:江西省2022-2023学年高一上学期选科调考化学试题



