1 . 学习化学知识能增强公民的科学素养,提升安全意识。下列实践活动和其所涉及的化学原理错误的是
选项 | 实践活动 | 化学原理 |
A | 家务清洁时洁厕灵和漂白液不能同时使用 | 两者同时使用会产生有毒气体 |
B | 禁止向下水道投放爆竹 | 下水道物质发酵产生可燃性气体 |
C | 用面粉做糕点时厨房不能有明火 | 面粉颗粒在空气中遇明火可能爆炸 |
D | 在易变质的食品中加双氧水 | 双氧水可以杀菌保鲜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-21更新
|
210次组卷
|
2卷引用:广东省韶关市2023-2024学年高三上学期第一次综合检测化学试题
2 . 下列说法中正确的是
| A.在医疗上,苏打是治疗胃酸过多的一种药剂 |
B.“侯氏制碱法”中的碱指的是 |
| C.大雾天气致使高速公路关闭,航班停飞,雾和石灰水都是胶体 |
D.区分 溶液和 溶液和 溶液可以用 溶液可以用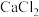 溶液 溶液 |
您最近一年使用:0次
2024-02-20更新
|
58次组卷
|
2卷引用:广东肇庆中学2023届高一上学期期中测试化学试题
名校
3 . 学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是______ ,胶体和溶液的本质区别是_______ 。
(2)生铁是______ (填“混合物”或“化合物”)。通常合金的熔点_____ (填“高于”或“低于”)其组成单质的熔点。
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得: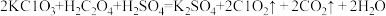 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为______ mol;该反应中的还原剂是______ (填化学式)。
(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=____ 。
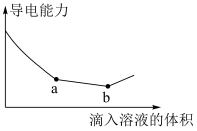
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是______ ,从a点到b点反应的离子方程式是______ ,解释b点之后导电能力上升的原因:______ 。
(1)云、雾属于胶体,鉴别胶体和溶液的方法是
(2)生铁是
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:
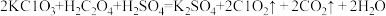 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是
您最近一年使用:0次
2024-01-28更新
|
109次组卷
|
4卷引用:广东省高州市某校2023-2024学年高一上学期期末模拟化学试题
名校
4 . “84消毒液”被广泛应用于物体表面杀菌消毒,化学兴趣小组设计了如图的实验装置制氯气探究氯气的性质并制备少量84消毒液:
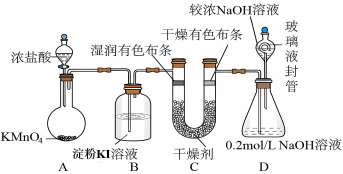
(1)盛放浓盐酸的仪器名称___________ ,酸性高锰酸钾作为强氧化剂其还原产物一般为Mn2+,装置A中反应的离子方程式是:___________ 。
(2)下列物质均可用于干燥气体,为了验证氯气是否具有漂白性,装置C应选择___________。
(3)装置D中的玻璃液封管中NaOH溶液的作用是___________ 。
(4)B装置可以观察到溶液开始变蓝后褪色,为探究其褪色的原因,取少许B溶液,滴加几滴碘水,溶液恢复蓝色,通过实验结果证明蓝色褪去的原因可能是___________ 。
(5)现在对锥形瓶中制备的消毒液进行定性和定量探究。
i.消毒液漂白性的探究,已知消毒液中起漂白作用的是HClO分子。
上述实验可以得到消毒液的漂白性强弱可能受___________ 影响。
ii.用Na2S2O3溶液和KI定量测定NaClO含量,其原理为: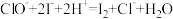 ;
; 。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到___________ 现象时,停止加入Na2S2O3。实验结束,测得共消耗20mLNa2S2O3,则计算消毒液中NaClO的浓度为___________ mol/L。

(1)盛放浓盐酸的仪器名称
(2)下列物质均可用于干燥气体,为了验证氯气是否具有漂白性,装置C应选择___________。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.无水CaCl2 |
(3)装置D中的玻璃液封管中NaOH溶液的作用是
(4)B装置可以观察到溶液开始变蓝后褪色,为探究其褪色的原因,取少许B溶液,滴加几滴碘水,溶液恢复蓝色,通过实验结果证明蓝色褪去的原因可能是
(5)现在对锥形瓶中制备的消毒液进行定性和定量探究。
i.消毒液漂白性的探究,已知消毒液中起漂白作用的是HClO分子。
| 实验组 | 试剂 | 现象 |
| ① | 10mL消毒液+1mL蒸馏水+红色纸条 | 2min后纸条红色褪去 |
| ② | 10mL消毒液+1mL稀硫酸+红色纸条 | 30s后纸条红色褪去 |
| ③ | 10mL消毒液+1mL稀NaOH+红色纸条 | 2min后纸条红色稍变浅 |
ii.用Na2S2O3溶液和KI定量测定NaClO含量,其原理为:
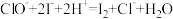 ;
; 。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
您最近一年使用:0次
2024-01-24更新
|
115次组卷
|
2卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题
名校
解题方法
5 . 实验室用废金属矿渣(主要成分是Al、Al2O3、Fe2O3、Fe3O4)为原料制备净水剂高铁酸钾(K2FeO4),流程如下:

(1)试剂a为___________ ,写出加入试剂a后Al发生的化学反应方程式___________ 。
(2)试剂b可以选择下列试剂___________ 。
①氨水②KI③H2O2④铁粉
并写出使用试剂b时,溶液中发生的离子反应方程式___________ 。证明溶液中试剂b加入的量不足的方法是___________ 。
(3)Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,KClO转化为KCl,制备过程中氧化剂与还原剂的物质的量之比为___________ 。
(4)实验室可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,制备1molNa2FeO4,反应转移的电子数目为___________ 。

(1)试剂a为
(2)试剂b可以选择下列试剂
①氨水②KI③H2O2④铁粉
并写出使用试剂b时,溶液中发生的离子反应方程式
(3)Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,KClO转化为KCl,制备过程中氧化剂与还原剂的物质的量之比为
(4)实验室可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,制备1molNa2FeO4,反应转移的电子数目为
您最近一年使用:0次
2024-01-24更新
|
201次组卷
|
2卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题
名校
解题方法
6 . 开发利用海水化学资源的部分过程如图所示,下列说法不正确的是___________ 。
(2)流程中的②③④⑤步中,属于非氧化还原反应的是___________ 。
(3)步骤④中Na2CO3溶液用于吸收Br2,根据Br2的性质,下列物质也可以用于大量吸收Br2的是___________。
(4)步骤⑤中仅有溴元素的化合价发生变化,每获取3molBr2,转移的电子数目为_________ 。
(5)粗盐中含有Mg2+、Ca2+、 ,得到精盐的步骤中添加试剂的顺序为
,得到精盐的步骤中添加试剂的顺序为___________ ,___________ ,NaOH、过滤、盐酸。(填试剂的化学式)
(6)利用步骤①中得到的精盐配制100mL0.1mol/L的NaCl溶液,实验中需要用到的玻璃仪器除了烧杯、玻璃棒还需要___________ 。

(2)流程中的②③④⑤步中,属于非氧化还原反应的是
(3)步骤④中Na2CO3溶液用于吸收Br2,根据Br2的性质,下列物质也可以用于大量吸收Br2的是___________。
| A.NaCl溶液 | B.FeCl3溶液 |
| C.酸性高锰酸钾溶液 | D.FeCl2溶液 |
(4)步骤⑤中仅有溴元素的化合价发生变化,每获取3molBr2,转移的电子数目为
(5)粗盐中含有Mg2+、Ca2+、
 ,得到精盐的步骤中添加试剂的顺序为
,得到精盐的步骤中添加试剂的顺序为(6)利用步骤①中得到的精盐配制100mL0.1mol/L的NaCl溶液,实验中需要用到的玻璃仪器除了烧杯、玻璃棒还需要
您最近一年使用:0次
2024-01-24更新
|
170次组卷
|
3卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题
名校
7 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
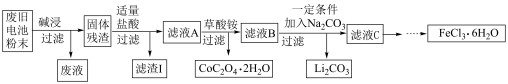
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
257次组卷
|
3卷引用:广东省茂名市七校2023-2024学年高一上学期12月联考化学试题
名校
解题方法
8 . 化学创造美好生活。下列生产活动与对应化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 用氢氧化钠固体和铝粉制成疏通剂疏通被油脂、毛发、菜渣等堵塞的管道 | 氢氧化钠具有吸水性 |
| B | 用小苏打粉作膨松剂焙制糕点 | 碳酸氢钠加热容易分解放出CO2 |
| C | 实践活动:用 FeCl3溶液腐蚀印刷电路板 | FeCl3有氧化性 |
| D | 用食醋清洗水壶内的水垢 | 醋酸的酸性比碳酸强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 2023年诺贝尔化学奖授予发现和合成量子点的三位科学家。碳量子点又称碳点,主要由碳氢氧元素组成,尺寸小于10nm,能在水中形成稳定的分散系。下列说法不正确的是
| A.碳点表面积大,吸附能力强 |
| B.碳点和金刚石互为同素异形体 |
| C.若将碳点均匀分散到蒸馏水中,可能产生丁达尔效应 |
| D.碳点的粒径小于滤纸的孔径,能透过滤纸 |
您最近一年使用:0次
2023-12-08更新
|
370次组卷
|
4卷引用:广东省佛山市南海区2023-2024学年高一上学期12月月考化学试题
名校
10 . 潮汕中秋拜月娘,月饼必不可少。每个月饼的包装盒里往往有两包化学试剂,生石灰和铁粉,它们的作用分别是

| A.干燥剂、脱氧剂(还原剂) |
| B.脱氧剂(还原剂)、干燥剂 |
| C.与CO2反应、干燥剂 |
| D.都做干燥剂,干燥更充分 |
您最近一年使用:0次
2023-12-02更新
|
317次组卷
|
6卷引用:广东省汕头市潮阳第一中学2023-2024学年高一上学期10月期中化学试题
广东省汕头市潮阳第一中学2023-2024学年高一上学期10月期中化学试题(已下线)专题03 铁 金属材料-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)(已下线)热点12 化学品的合理利用(已下线)8.2化学品的合理使用课后作业提高篇(已下线)8.2.2 安全使用食品添加剂8.2.2安全使用食品添加剂 随堂练习



