名校
1 . 向500 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是

 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
A.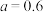 |
B. 时反应为 时反应为 |
C.原溶液中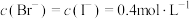 |
D.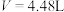 时总反应为 时总反应为 |
您最近一年使用:0次
2024-02-23更新
|
244次组卷
|
2卷引用:湖北省荆州八县市2023-2024学年高一上学期期末联考化学试题
2 . 用富含铁元素的食品,可以补充人体所需的铁元素。某班级研究性学习小组对菠菜中的铁元素展开了检测,实验如下:

(1)下列图示装置或操作合理的是________ 。
(2)写出试剂B的化学式___________ 。
(3)试剂C若为双氧水,请写出该反应的离子方程式:___________ ;该实验证明菠菜中含有的铁元素为_____ 价。
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?______ ,原因是什么?___________ 。
(5)另取少量滤液 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是________ ;原因是___________ 、________ (用离子方程式解释)。

(1)下列图示装置或操作合理的是
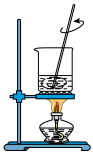 |  |  |  |
| A.灼烧 | B.溶解 | C.过滤 | D.检测菠菜液中的铁元素 |
(2)写出试剂B的化学式
(3)试剂C若为双氧水,请写出该反应的离子方程式:
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?
(5)另取少量滤液
 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是
您最近一年使用:0次
名校
解题方法
3 . 下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中: 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、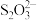 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO 、I-、Cl-
、I-、Cl-
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:
 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、
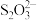 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、
 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO
 、I-、Cl-
、I-、Cl-| A.①② | B.③⑥ | C.②④ | D.③⑤ |
您最近一年使用:0次
2023-08-26更新
|
1315次组卷
|
3卷引用:第1课时 离子反应发生的条件
解题方法
4 . 某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
【实验1】试剂:酸化的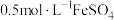 溶液(
溶液( ),
),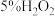 溶液(
溶液( )
)
(1)上述实验中 溶液与
溶液与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
(2)产生气泡的原因是_______ 。
【实验Ⅱ】试剂:未酸化的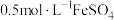 溶液(
溶液( ),
), 溶液(
溶液( )
)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加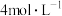 盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有
盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 ,经检验还含有
,经检验还含有 。检验棕黄色沉淀中
。检验棕黄色沉淀中 的方法是
的方法是_______ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ. 溶液氧化
溶液氧化 消耗
消耗
ⅱ. 氧化的产物发生了水解
氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是_______ 。
②实验验证假设ⅱ:取_______ ,加热,溶液变为红褐色, 下降,证明假设ⅱ成立。
下降,证明假设ⅱ成立。
(5)将 溶液加入
溶液加入 溶液后,产生红褐色胶体,反应的离子方程式是:
溶液后,产生红褐色胶体,反应的离子方程式是:_______ 。
 溶液的反应。
溶液的反应。【实验1】试剂:酸化的
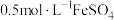 溶液(
溶液( ),
),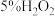 溶液(
溶液( )
)| 操作 | 现象 |
取 上述 上述 溶液于试管中,加入5滴 溶液于试管中,加入5滴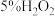 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与
溶液与 溶液反应的离子方程式是
溶液反应的离子方程式是(2)产生气泡的原因是
【实验Ⅱ】试剂:未酸化的
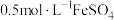 溶液(
溶液( ),
), 溶液(
溶液( )
)| 操作 | 现象 |
取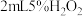 溶液于试管中,加入5滴上述 溶液于试管中,加入5滴上述 溶液 溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液 |
 盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有
盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 ,经检验还含有
,经检验还含有 。检验棕黄色沉淀中
。检验棕黄色沉淀中 的方法是
的方法是(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.
 溶液氧化
溶液氧化 消耗
消耗
ⅱ.
 氧化的产物发生了水解
氧化的产物发生了水解①根据实验Ⅱ记录否定假设ⅰ,理由是
②实验验证假设ⅱ:取
 下降,证明假设ⅱ成立。
下降,证明假设ⅱ成立。(5)将
 溶液加入
溶液加入 溶液后,产生红褐色胶体,反应的离子方程式是:
溶液后,产生红褐色胶体,反应的离子方程式是:
您最近一年使用:0次
2023-07-05更新
|
350次组卷
|
3卷引用:广东省汕头市2022-2023学年高二下学期7月期末考试化学试题
名校
5 . 向 100 mL 3.0 mol/L 的FeBr2溶液中逐渐通入Cl2,其中 n(Fe3+)、n(Fe2+)、n(Br-) 随通入Cl2的物质的量 n(Cl2)变化如图所示,下列说法错误的是
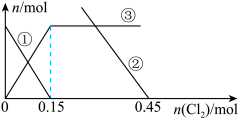
注意:②代表离子的物质的量变化图没有完全画出

注意:②代表离子的物质的量变化图没有完全画出
| A.②代表Br-,③代表Fe3+ |
| B.还原性强弱:Fe2+>Br- |
| C.n(Cl2)=0.5 mol时,总的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| D.n(Cl2)=0.35 mol时,溶液中c(Fe3+)=c(Br-) |
您最近一年使用:0次
名校
解题方法
6 . 已知:①绿茶中含有大量的鞣酸;②鞣酸亚铁溶液为无色,鞣酸铁溶液为蓝黑色。根据如图所示的实验流程分析,下列叙述错误的是
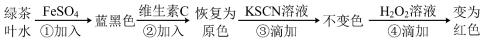
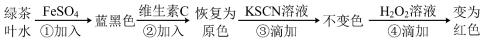
| A.反应①中绿茶叶水与FeSO4反应直接生成鞣酸铁而呈蓝黑色 |
| B.反应②中维生素C体现出还原性 |
| C.反应④中H2O2可以替换为新制氯水 |
| D.绿茶叶水不宜与补铁剂同时服用 |
您最近一年使用:0次
2023-03-03更新
|
478次组卷
|
3卷引用:广东省翁源县红岭中学2022-2023学年高一上学期第二学段考试期末考试化学试题
7 . 某电子厂腐蚀废液含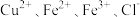 ,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得
,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得 溶液,请根据以下流程图,回答下列问题。
溶液,请根据以下流程图,回答下列问题。
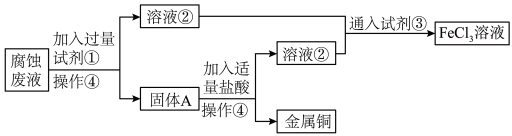
(1)②_______ (化学式)、③_______ (化学式)、④_______ (操作)。
(2)腐蚀废液中加入过量试剂①,写出发生反应的离子方程式_______ 。
(3)证明溶液②中不含 ,可往溶液中滴加
,可往溶液中滴加_______ (化学式)溶液。
(4)若已知处理前原腐蚀废液中 的质量
的质量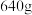 ,固体A的质量
,固体A的质量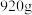 ,则流程图中加入适量盐酸(浓度
,则流程图中加入适量盐酸(浓度 )的体积至少
)的体积至少_______ L。
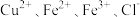 ,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得
,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得 溶液,请根据以下流程图,回答下列问题。
溶液,请根据以下流程图,回答下列问题。
(1)②
(2)腐蚀废液中加入过量试剂①,写出发生反应的离子方程式
(3)证明溶液②中不含
 ,可往溶液中滴加
,可往溶液中滴加(4)若已知处理前原腐蚀废液中
 的质量
的质量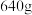 ,固体A的质量
,固体A的质量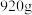 ,则流程图中加入适量盐酸(浓度
,则流程图中加入适量盐酸(浓度 )的体积至少
)的体积至少
您最近一年使用:0次
2023-02-10更新
|
240次组卷
|
2卷引用:广东省江门市2022-2023学年高一上学期调研测试(一)期末考试化学试题
名校
8 . 向仅含有 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。

提示:①不考虑 、
、 与水的反应;
与水的反应;
②不考虑气体的逸出;
③不考虑水电离出的 和
和 。
。
④产物只有 、
、 和
和 。
。
回答下列问题:
(1)
_______ ,曲线I对应的离子方程式为_______ 。
(2)b点溶液中,共含有_______ 种离子,分别为_______ (填离子符号)。
(3)
_______ ,曲线II对应的离子方程式为_______ 。
(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为_______ 。
 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
提示:①不考虑
 、
、 与水的反应;
与水的反应;②不考虑气体的逸出;
③不考虑水电离出的
 和
和 。
。④产物只有
 、
、 和
和 。
。回答下列问题:
(1)

(2)b点溶液中,共含有
(3)

(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为
您最近一年使用:0次
2023-02-08更新
|
519次组卷
|
4卷引用:河北省保定市定州市第二中学2022-2023学年高一下学期开学考试化学试题
9 . 某班同学用如下实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,继续煮沸至液体呈透明的
溶液,继续煮沸至液体呈透明的_________ 色,停止加热,即制得 胶体。用激光笔照射烧杯中的液体,可以看到
胶体。用激光笔照射烧杯中的液体,可以看到_________ 。
(2)甲组同学通过研究pH对 稳定性的影响,得到如图1所示结果,增强
稳定性的影响,得到如图1所示结果,增强 稳定性的措施为
稳定性的措施为_________ 。

(3)乙组同学为探究 与Cu的反应,进行如图2所示实验:
与Cu的反应,进行如图2所示实验:

① 与Cu反应的离子方程式为
与Cu反应的离子方程式为_________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;
ⅱ. 的化学性质与
的化学性质与 相似;
相似;
ⅲ. 。
。
填写实验方案:
 与
与 反应的离子方程式为
反应的离子方程式为_________ 。
(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有 ,设计方案进行验证。
,设计方案进行验证。
①方案ⅰ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有 ,猜想理由是
,猜想理由是_________ 。
②方案ⅱ中预期现象是_________ ;若方案ⅱ实际操作中自始至终无明显现象,说明符合方案ⅰ猜想理由。为验证猜想,在方案ⅱ的基础上可进行操作:_________ ,即可得到预期的现象。
 、
、 的性质。回答下列问题:
的性质。回答下列问题:(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
 溶液,继续煮沸至液体呈透明的
溶液,继续煮沸至液体呈透明的 胶体。用激光笔照射烧杯中的液体,可以看到
胶体。用激光笔照射烧杯中的液体,可以看到(2)甲组同学通过研究pH对
 稳定性的影响,得到如图1所示结果,增强
稳定性的影响,得到如图1所示结果,增强 稳定性的措施为
稳定性的措施为
(3)乙组同学为探究
 与Cu的反应,进行如图2所示实验:
与Cu的反应,进行如图2所示实验:
①
 与Cu反应的离子方程式为
与Cu反应的离子方程式为②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;
ⅱ.
 的化学性质与
的化学性质与 相似;
相似;ⅲ.
 。
。填写实验方案:
| 实验方案 | 实验现象 |
步骤1:取4mL0.2mol/L的 溶液,向其中滴加3滴0.1mol/LKSCN溶液 溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
步骤2:取4mL 溶液,向其中滴加3滴0.1mol/LKSCN溶液 溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 |
 与
与 反应的离子方程式为
反应的离子方程式为(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有
 ,设计方案进行验证。
,设计方案进行验证。 | 方案 | 试剂X |
| 方案ⅰ | 1mL1mol/L酸性 溶液 溶液 | |
| 方案ⅱ | 依次加入5滴KSCN溶液、1mL氯水 |
 ,猜想理由是
,猜想理由是②方案ⅱ中预期现象是
您最近一年使用:0次
2023-01-08更新
|
190次组卷
|
2卷引用:陕西省汉中市2021-2022学年高一上学期期末校际联考化学试题
名校
10 . 某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有 ,设计方案进行验证。
,设计方案进行验证。

Ⅰ.设计方案如下:
(1)方案ⅰ的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。白色沉淀最终变为红褐色所涉及的化学方程式是_______ 。
(2)方案ⅱ的预期现象是_______ 。
(3)方案ⅲ的预期现象是_______ 。反应中双氧水参与反应的离子方程式是_______ 。
Ⅱ.进行实验操作,得到的实际现象如下:
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
结合资料对异常现象产生的原因进行猜想:_______ ;为验证其猜想,在方案ⅱ的基础上继续加入过量的酸性 溶液,到了预期的现象。
溶液,到了预期的现象。
(5)实验反思:方案ⅱ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有 ,理由是
,理由是_______ 。
(6)某兴趣小组同学进一步查阅资料,发现某种补铁口服液中 的含量为0.784mg/mL,则该补铁口服液中
的含量为0.784mg/mL,则该补铁口服液中
_______ mol/L。
 ,设计方案进行验证。
,设计方案进行验证。
Ⅰ.设计方案如下:
 | 方案 | 试剂X | 预期现象 |
| 方案ⅰ | 1mL1mol/LNaOH溶液 | a | |
| 方案ⅱ | 1mL1mol/L酸性 溶液 溶液 | b | |
| 方案ⅲ | 依次加入5滴KSCN溶液、1mL酸性 溶液 溶液 | c |
(2)方案ⅱ的预期现象是
(3)方案ⅲ的预期现象是
Ⅱ.进行实验操作,得到的实际现象如下:
| 方案 | 实际现象 | 是否与预期现象相同 |
| 方案ⅰ | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
| 方案ⅱ | 相同 | |
| 方案ⅲ | 自始至终无明显现象 | 不同 |
| 本品每毫升含主要成分葡萄糖酸亚铁30毫克,辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。 |
 溶液,到了预期的现象。
溶液,到了预期的现象。(5)实验反思:方案ⅱ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有
 ,理由是
,理由是(6)某兴趣小组同学进一步查阅资料,发现某种补铁口服液中
 的含量为0.784mg/mL,则该补铁口服液中
的含量为0.784mg/mL,则该补铁口服液中
您最近一年使用:0次



