名校
解题方法
1 . 已知: +I2+H2O=
+I2+H2O= +2H++2I-,某溶液中可能含有I-、
+2H++2I-,某溶液中可能含有I-、 、Cu2+、
、Cu2+、 ,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是
,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是
 +I2+H2O=
+I2+H2O= +2H++2I-,某溶液中可能含有I-、
+2H++2I-,某溶液中可能含有I-、 、Cu2+、
、Cu2+、 ,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是
,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是| A.肯定不含I- | B.肯定不含Cu2+ |
C.可能含有 | D.可能含有I- |
您最近一年使用:0次
2 . 将①中溶液滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测中的现象 |
A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-29更新
|
195次组卷
|
4卷引用:上海市嘉定区2021届高三一模化学试题
上海市嘉定区2021届高三一模化学试题上海市宝山中学2022-2023学年高三上学期期中考试化学试题(已下线)重点7 探究型实验综合题-2021年高考化学专练【热点·重点·难点】陕西省汉中市2020-2021学年高二下学期期中联考化学试题
名校
解题方法
3 . 下列物质在空气中变质与二氧化碳无关的是
| A.漂粉精 | B.生石灰 | C.过氧化钠 | D.亚硫酸钠 |
您最近一年使用:0次
2020-10-15更新
|
215次组卷
|
5卷引用:上海市建平中学2021届高三上学期9月月考化学试题
名校
解题方法
4 . 下列现象或事实可用同一原理解释的是( )
| A.分别加热固体碘和氯化铵晶体 |
| B.漂粉精和亚硫酸钠固体长期暴露在空气中变质 |
| C.硫磺和木炭燃烧 |
| D.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
您最近一年使用:0次
2020-10-04更新
|
106次组卷
|
2卷引用:上海市格致中学2020届高三上学期12月月考化学试题
5 . 向含有下列微粒的溶液中分别加入少量 NaOH固体、少量浓盐酸或少量高锰酸钾溶液,都能使该微粒浓度下降的是( )
| A.Fe2+ | B.S2- | C.HSO | D.NH |
您最近一年使用:0次
解题方法
6 . 从宏观和微观两个角度认识氯、硫、铁、铝等元素的单质及其化合物是学好中学化学的重要基础。完成下列填空:
(1)Cl在元素周期表中的位置为______________ ,由此可知,其最高价氧化物对应的水化物的化学式 为:______________ ,次氯酸分子的结构式为:_____________ 。
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是_______________________ (用离子符号 表示)。铝最高价氧化物对应的水化物表现出了独特的性质,其在水溶液中的电离方程式 为____________________________________________________________________________ 。
(3)硫和氯的非金属性强弱关系是_________________ ,试从原子结构的角度解释其原因。______________
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原 性,应选用的试剂有______________ ,看到的现象是 ____________________ 。要证明Na2SO3具有氧化性,应选用的试剂有___________________ ,反应的离子方程式是 ________________________________ 。
(1)Cl在元素周期表中的位置为
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是
(3)硫和氯的非金属性强弱关系是
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原 性,应选用的试剂有
您最近一年使用:0次
名校
解题方法
7 . 氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_____ (选填编号)。
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。
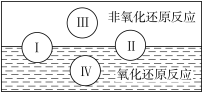
试写出有水参加且符合反应类型 IV 的一个化学方程式:___________________ 。
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
_____ NaIO3+ NaHSO3→ I2+ Na2SO4+ H2SO4+ H2O
②该反应还原剂是_____ ,_____ 元素被还原,若生成 1mol 氧化产物则转移电子数目为_____ NA。
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-_____ I-(填“>”或“<”),完成该反应_____________________________________ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。

试写出有水参加且符合反应类型 IV 的一个化学方程式:
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
②该反应还原剂是
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-
您最近一年使用:0次
2017-12-22更新
|
286次组卷
|
2卷引用:上海交通大学附属中学2017-2018学年高一12月月考化学试题
8 . 为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________ 、________ 。
(2)写出Na2SO3固体氧化变质的化学方程式_____________ 。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________ ,
在过滤前,需要检验是否沉淀完全,其操作是______________ 。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________ (填“偏高”或“偏低”)。
(5)若操作正确,则m1________ m2(填“>”、“<”或“=”),原因是_______________ 。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________ (注明表达式中所用的有关符号的含义和单位)。
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、
(2)写出Na2SO3固体氧化变质的化学方程式
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是
在过滤前,需要检验是否沉淀完全,其操作是
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果
(5)若操作正确,则m1
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为
您最近一年使用:0次
2017-06-26更新
|
263次组卷
|
3卷引用:上海市长宁区2016届高考一模化学试题



