1 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| B | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
| C | 取5mL0.1mol•L−1KI溶液,加入1mL0.1mol•L−1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆逆反应 |
| D | 向盛有5mLAgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液有黄色沉淀产生 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45 ℃熔化,48 ℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3·5H2O晶体【Na2SO3(aq)+S(s)  Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:
① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)
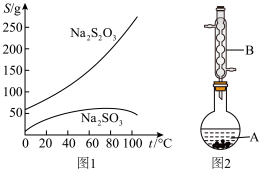
(1) 图2中,仪器B的名称是___________ 。
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是___________ 。
(3) 实验步骤③中,趁热过滤的原因是___________ 。
(4) 实验步骤④中,应采取的相关实验操作为___________ 。
(5) 实验步骤⑤中,采用低温干燥的目的是___________ 。
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___________ 。
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是___________ 。消耗碘的标准溶液体积为36.00 mL,产品的纯度为___________ 。
 Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)

(1) 图2中,仪器B的名称是
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是
(3) 实验步骤③中,趁热过滤的原因是
(4) 实验步骤④中,应采取的相关实验操作为
(5) 实验步骤⑤中,采用低温干燥的目的是
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O
 +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是
您最近一年使用:0次
2020-12-28更新
|
301次组卷
|
7卷引用:江苏省扬州市公道中学2020-2021学年下学期高二第二次学情测试化学试题
名校
解题方法
3 . 在探究SO2的性质实验中,下列实验现象及得出的结论不正确的是
| A.向溴水中通入SO2,溶液褪色,说明SO2具有还原性 |
| B.向紫色石蕊溶液中通入SO2,溶液由先变红色后褪色,说明SO2具有漂白性 |
| C.向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO4 |
| D.向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3的酸性强于H2CO3 |
您最近一年使用:0次
4 . 根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 将含有SO2的废气通入BaCl2溶液中,生成白色沉淀 | SO2与BaCl2溶液反应生成BaSO3沉淀 |
| B | 向溶液X中先滴加稀硝酸,再滴加BaCl2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| C | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中可能含Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 氯化亚铜(CuCl) 是一种应用较广的催化剂,有关物质的转化关系如下图所示(除B、E外,均为对应物质的溶液参加反应,部分生成物和反应条件已略去)。其中B 为气体,常用于纸张的漂白; C 为正盐,D 为重要的调味剂,E 为一种红色的金属氧化物,M 溶液常作医用消毒液。
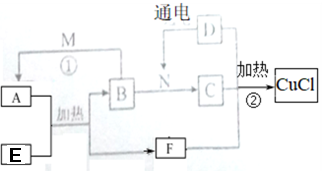
(1)E的化学式______________ ,N的电子式为______________ 。
(2)写出反应①的化学方程式:__________________ 。
(3)写出反应②的离子方程式:_________________ 。

(1)E的化学式
(2)写出反应①的化学方程式:
(3)写出反应②的离子方程式:
您最近一年使用:0次



