1 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
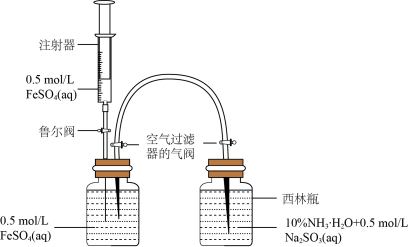
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在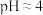 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且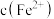 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
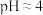 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且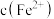 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  | 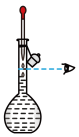 | 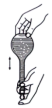 |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近一年使用:0次
解题方法
2 . 化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:

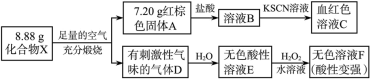
请回答:
(1)X的化学式为___________ 。
(2)请写出E反应生成F的化学方程式:___________ 。
(3)化合物X(只含两种元素)与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:___________ 。


请回答:
(1)X的化学式为
(2)请写出E反应生成F的化学方程式:
(3)化合物X(只含两种元素)与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 下列除杂试剂或方法正确的是
| 选项 | 被提纯物质 | 杂质 | 除杂试剂或方法 |
| A |  溶液 溶液 |  | 加入过量 溶液并过滤、洗涤 溶液并过滤、洗涤再将沉淀溶于适量盐酸 |
| B | 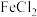 溶液 溶液 |  | 加入过量铜粉并过滤、洗涤 |
| C |  |  | 在空气中灼烧至质量不再变化 |
| D |  |  | 在空气中灼烧至质量不再变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 焦亚硫酸钠(Na2S2O5)常用作葡萄酒、果脯等食品的抗氧化剂。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为___________ 。
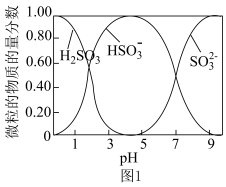
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,___________ ,20℃静置结晶,经减压抽滤、洗涤、25~30 ℃干燥,可获得Na2S2O5固体。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是___________ 。
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是___________ 。
(5)通过计算判断该样品是否为优质品是___________ (写出计算过程)。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,

(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是
(5)通过计算判断该样品是否为优质品是
您最近一年使用:0次
名校
解题方法
5 . 硫及其化合物在生产、生活和科学研究中有着广泛的作用。对燃煤烟气脱硫能有效减少对大气的污染并实现资源化利用。方法1用氨水将  先转化为
先转化为 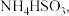 再氧化为
再氧化为 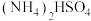 ;方法2用生物质热解气(主要成分为CO、CH4、H2)将
;方法2用生物质热解气(主要成分为CO、CH4、H2)将  在高温下还原为单质硫;方法3用
在高温下还原为单质硫;方法3用  溶液吸收
溶液吸收  生成
生成  ,再加热吸收液,使之重新生成亚硫酸钠;方法4用
,再加热吸收液,使之重新生成亚硫酸钠;方法4用  溶液吸收烟气中
溶液吸收烟气中  ,使用惰性电极电解吸收后的溶液,
,使用惰性电极电解吸收后的溶液, 在阴极被还原为硫单质。可以用
在阴极被还原为硫单质。可以用  溶液除去
溶液除去 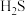 气体,生成黑色
气体,生成黑色  沉淀。下列化学反应表示不正确的是
沉淀。下列化学反应表示不正确的是
 先转化为
先转化为 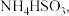 再氧化为
再氧化为 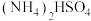 ;方法2用生物质热解气(主要成分为CO、CH4、H2)将
;方法2用生物质热解气(主要成分为CO、CH4、H2)将  在高温下还原为单质硫;方法3用
在高温下还原为单质硫;方法3用  溶液吸收
溶液吸收  生成
生成  ,再加热吸收液,使之重新生成亚硫酸钠;方法4用
,再加热吸收液,使之重新生成亚硫酸钠;方法4用  溶液吸收烟气中
溶液吸收烟气中  ,使用惰性电极电解吸收后的溶液,
,使用惰性电极电解吸收后的溶液, 在阴极被还原为硫单质。可以用
在阴极被还原为硫单质。可以用  溶液除去
溶液除去 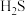 气体,生成黑色
气体,生成黑色  沉淀。下列化学反应表示不正确的是
沉淀。下列化学反应表示不正确的是A.氨水吸收  的反应: 的反应: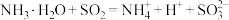 |
B. 还原 还原  的反应:2CO+SO2 的反应:2CO+SO2 S+2CO2 S+2CO2 |
C. 吸收液再生的反应: 吸收液再生的反应: |
D.电解吸收  后的溶液的总反应:3H2SO3 后的溶液的总反应:3H2SO3 S↓+2H2SO4+H2O S↓+2H2SO4+H2O |
您最近一年使用:0次
名校
6 . 书写下列反应的离子 方程式:
(1)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2.上述制备I2的总反应___________ 。
(2)在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+
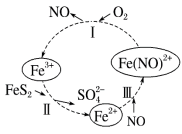
①反应I:___________ 。
②反应II:___________ 。
(3)红磷充分燃烧的产物与足量热的NaOH溶液反应,该反应的离子方程式是___________ 。
(4)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈褐色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是___________ 。
(5)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:
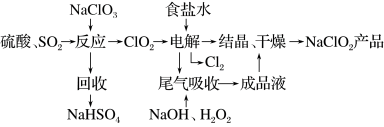
①写出“反应”步骤中生成ClO2的化学方程式:___________ 。
② “电解”过程阴极主反应的方程式:___________ 。
③“尾气吸收”是吸收“电解”过程排出的少量ClO2,写出此吸收反应的离子方程式:___________ 。
(1)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2.上述制备I2的总反应
(2)在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
①反应I:
②反应II:
(3)红磷充分燃烧的产物与足量热的NaOH溶液反应,该反应的离子方程式是
(4)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈褐色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(5)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:

①写出“反应”步骤中生成ClO2的化学方程式:
② “电解”过程阴极主反应的方程式:
③“尾气吸收”是吸收“电解”过程排出的少量ClO2,写出此吸收反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 下列的各组离子在酸性溶液中能大量共存的是
A.Na+、Ca2+、 、ClO- 、ClO- | B.Ca2+、K+、Cl-、 |
C.Al3+、K+、OH-、 | D.Na+、Ca2+、 、Cl- 、Cl- |
您最近一年使用:0次
2024-02-16更新
|
178次组卷
|
3卷引用:江西省景德镇市乐平市第三中学2023-2024学年高一下学期3月月考化学试题
8 . “价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是

| A.a可用硫化亚铁与稀硝酸反应制取 |
B.可发生反应: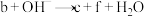 (未配平) (未配平) |
| C.c能使溴水褪色,证明c有漂白性 |
| D.f既有氧化性又有还原性 |
您最近一年使用:0次
2024-02-14更新
|
649次组卷
|
8卷引用:河北省石家庄市第二十三中学2023-2024学年高一下学期第一次月考(3月)化学试题
河北省石家庄市第二十三中学2023-2024学年高一下学期第一次月考(3月)化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题河南省新乡市原阳县实验高级中学2023-2024学年高一下学期3月月考化学试题重庆市璧山来凤中学校2023-2024学年高一下学期3月月考化学试题江苏省南宁市第三十三中学2023-2024学年高一下学期3月月考化学试题河北省承德市2023-2024学年高一上学期期末考试化学试题(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题
9 . 碘酸钾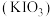 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。
I.制备
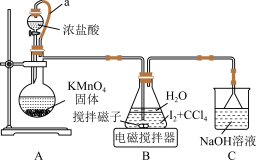
制备 实验装置如图:
实验装置如图:
查阅资料: 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。
(1)装置 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是___________ 。
(2)装置 中制取
中制取 的化学反应方程式为
的化学反应方程式为___________ 。
II.制备
(3)从B中分离出 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和___________ 。加入 溶液中和制得
溶液中和制得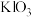 溶液,再加入适量
溶液,再加入适量___________ ,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得 晶体。
晶体。
III.实验探究
为探究 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(4)溶液变蓝,表明 体现了
体现了___________ 性。
(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。
ii.猜想b:T秒前生成了 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为___________ (用离子方程式表示)。
(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的___________ (填化学式)溶液,蓝色迅速消失,后再次变蓝。
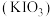 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。I.制备

制备
 实验装置如图:
实验装置如图:
查阅资料:
 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。(1)装置
 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是(2)装置
 中制取
中制取 的化学反应方程式为
的化学反应方程式为II.制备

(3)从B中分离出
 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和 溶液中和制得
溶液中和制得 溶液,再加入适量
溶液,再加入适量 晶体。
晶体。III.实验探究
为探究
 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。(4)溶液变蓝,表明
 体现了
体现了(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想
 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。ii.猜想b:T秒前生成了
 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的
您最近一年使用:0次
名校
解题方法
10 . 氯、硫元素的价类二维图如图所示。下列说法正确的是
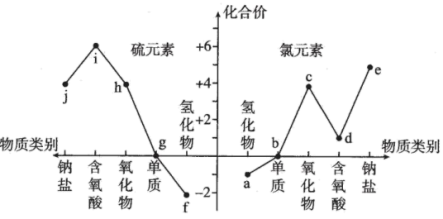
| A.i与j能发生氧化还原反应 |
| B.d、h的水溶液在空气中久置,溶液酸性均减弱 |
| C.Fe分别与b、g反应,产物中铁元素的化合价相同 |
D.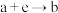 反应的离子方程式为 反应的离子方程式为 |
您最近一年使用:0次
2024-02-03更新
|
324次组卷
|
3卷引用:湖北省黄冈市黄梅县晋梅高级中学2023-2024学年高一下学期3月月考化学试题



