解题方法
1 . 有一包固体粉末,由NaOH、Na2SO3、MgCl2、CaCO3、Ba( NO3)2、FeSO4中的几种组成,取少量样品进行如下实验:
①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是
①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是
| A.CaCO3、Ba( NO3)2 | B.CaCO3、Na2SO3 |
| C.Na2SO3、Ba( NO3)2 | D.CaCO3、Na2SO3、Ba( NO3)2 |
您最近一年使用:0次
2022·江苏连云港·二模
2 . 含SO2的工业烟气脱硫往往使用较为廉价的碱性物质如生石灰、浓氨水等吸收。近年来一些近海的煤电厂,利用海水的微碱性(8.0≤pH≤8.3)开发海水脱硫新工艺。主要原理是:SO2与海水生成H2SO3,H2SO3电离得到HSO 和SO
和SO 进一步氧化得到SO
进一步氧化得到SO 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO 和CO
和CO )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。中和反应过程需要鼓入大量空气。下列说法与通入空气作用
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。中和反应过程需要鼓入大量空气。下列说法与通入空气作用无关 的是
 和SO
和SO 进一步氧化得到SO
进一步氧化得到SO 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO 和CO
和CO )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。中和反应过程需要鼓入大量空气。下列说法与通入空气作用
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。中和反应过程需要鼓入大量空气。下列说法与通入空气作用A.将SO 氧化成为SO 氧化成为SO | B.将产生的CO2赶出水面 |
| C.提高脱硫海水中的含氧量 | D.提高脱硫海水中碳酸盐的浓度 |
您最近一年使用:0次
2022·全国·模拟预测
名校
解题方法
3 . 焦亚硫酸钠(Na2S2O5)在印染、电镀、酿造等工业生产中广泛应用,其制备流程如图所示。下列说法正确的是
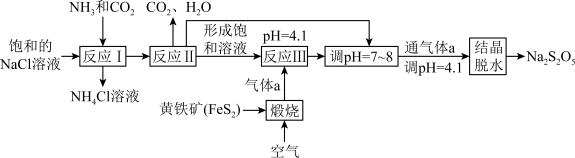
| A.反应I制备Na2CO3,反应时先通入氨气,再通入CO2 |
B.气体a为SO2,反应III为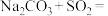 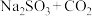 |
| C.调pH=7~8,并再次通入气体a的目的是得到NaHSO3过饱和溶液 |
D.结晶后的脱水反应为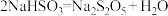 |
您最近一年使用:0次
2022-03-24更新
|
463次组卷
|
4卷引用:高考化学预测卷(二)
4 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
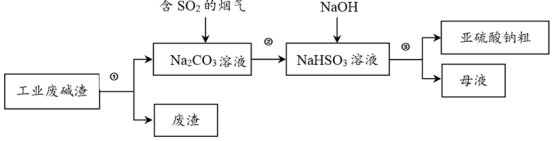
(1)为加快工业废碱渣中Na2CO3的溶解,可采取的措施是_______ (写出一种即可)。
(2)过程①进行的操作是_______ 。
(3)上述流程中,加入NaOH后,发生反应的化学方程式为_______ 。
(4)亚硫酸钠粗品中含有少量Na2SO4,原因是_______ 。
(5)设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______ ,出现白色沉淀,则证明含有Na2SO4。

(1)为加快工业废碱渣中Na2CO3的溶解,可采取的措施是
(2)过程①进行的操作是
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量Na2SO4,原因是
(5)设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
您最近一年使用:0次
2021-05-20更新
|
798次组卷
|
3卷引用:2022年新高考化学时事热点情境化考题---钠及其化合物
5 . Co2O3主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为Co2O3,含少量Fe2O3、SiO2及铝、镁、钙等金属元素的氧化物)制取Co2O3的工艺流程如图所示。

已知部分阳离子以氢氧化物形式沉淀时溶液pH如下表:
回答下列问题:
(1)溶浸过程中,可以加快反应速率和提高原料利用率的方法是__ (写出1种即可);加入Na2SO3的主要作用是__ 。
(2)氧化除杂过程中金属离子与NaClO3反应的离子方程式为___ ,加入Na2CO3的主要目的是___ 。
(3)配制80mL1.0mol·L−1的(NH4)2C2O4溶液,需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外,还有___ 。
(4)已知某温度下Ksp(CaF2)=3.4×10−11,Ksp(MgF2)=7.1×10−11。该温度下,沉淀除杂时加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中c(Mg2+)=1.0×10−5mol·L−1,则滤液中c(Ca2+)为___ (保留2位有效数字)。
(5)①取CoC2O4·2H2O晶体在空气中加热至400℃~600℃充分煅烧得到产品,反应中CoC2O4·2H2O与O2的化学计量数之比为____ 。
②若取CoC2O4·2H2O晶体5.49g在空气中加热至300℃,得到钴的某种氧化物2.41g,则该反应的化学方程式为____ 。

已知部分阳离子以氢氧化物形式沉淀时溶液pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 |
回答下列问题:
(1)溶浸过程中,可以加快反应速率和提高原料利用率的方法是
(2)氧化除杂过程中金属离子与NaClO3反应的离子方程式为
(3)配制80mL1.0mol·L−1的(NH4)2C2O4溶液,需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外,还有
(4)已知某温度下Ksp(CaF2)=3.4×10−11,Ksp(MgF2)=7.1×10−11。该温度下,沉淀除杂时加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中c(Mg2+)=1.0×10−5mol·L−1,则滤液中c(Ca2+)为
(5)①取CoC2O4·2H2O晶体在空气中加热至400℃~600℃充分煅烧得到产品,反应中CoC2O4·2H2O与O2的化学计量数之比为
②若取CoC2O4·2H2O晶体5.49g在空气中加热至300℃,得到钴的某种氧化物2.41g,则该反应的化学方程式为
您最近一年使用:0次



