1 . 二氧化硫是形成酸雨的“罪魁祸首”,为了保护环境,应减少二氧化硫在大气中的排放。请回答下列问题(已知二氧化硫和二氧化碳性质类似,亚硫酸和碳酸性质类似):
(1)二氧化硫与水反应可生成亚硫酸(H2SO3),那么二氧化硫是_______ 氧化物(填酸性或碱性)。
(2)工业尾气中的二氧化硫常用氢氧化钠溶液吸收,生成亚硫酸钠或亚硫酸氢钠:
①亚硫酸氢钠溶于水的电离方程式是_______ ;
②亚硫酸氢钠和氢氧化钠反应离子方程式_______ 。
(3)二氧化硫在催化剂的作用下可被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸:
①硫酸和亚硫酸钠反应离子方程式_______ ;
②氧气也能氧化亚硫酸使雨水酸性更强,该反应的化学方程式是_______ 。
(1)二氧化硫与水反应可生成亚硫酸(H2SO3),那么二氧化硫是
(2)工业尾气中的二氧化硫常用氢氧化钠溶液吸收,生成亚硫酸钠或亚硫酸氢钠:
①亚硫酸氢钠溶于水的电离方程式是
②亚硫酸氢钠和氢氧化钠反应离子方程式
(3)二氧化硫在催化剂的作用下可被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸:
①硫酸和亚硫酸钠反应离子方程式
②氧气也能氧化亚硫酸使雨水酸性更强,该反应的化学方程式是
您最近半年使用:0次
名校
2 . 钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是____ 。
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式______ 。
ClO + VO2++ = Cl-+ VO
+ VO2++ = Cl-+ VO +
+
(3) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是____ 。
(4)在20.00 mL 0.1 mol.L-1 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 ___ 。
a.VO2+ b. c. V2+ d.V
c. V2+ d.V
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式
ClO
 + VO2++ = Cl-+ VO
+ VO2++ = Cl-+ VO +
+ (3) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是(4)在20.00 mL 0.1 mol.L-1
 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 a.VO2+ b.
 c. V2+ d.V
c. V2+ d.V
您最近半年使用:0次
2021-01-31更新
|
660次组卷
|
4卷引用:安徽省合肥市2021年高三第一次教学质量检测化学试题
安徽省合肥市2021年高三第一次教学质量检测化学试题(已下线)热点10 氧化还原反应与电极反应-2021年高考化学【热点·重点·难点】专练(新高考)山东省泰安市宁阳县第四中学2022-2023学年高三上学期10月月考化学试题(等级考)山东省泰安市宁阳县第四中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
3 . 氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_____ (选填编号)。
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。
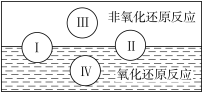
试写出有水参加且符合反应类型 IV 的一个化学方程式:___________________ 。
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
_____ NaIO3+ NaHSO3→ I2+ Na2SO4+ H2SO4+ H2O
②该反应还原剂是_____ ,_____ 元素被还原,若生成 1mol 氧化产物则转移电子数目为_____ NA。
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-_____ I-(填“>”或“<”),完成该反应_____________________________________ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。

试写出有水参加且符合反应类型 IV 的一个化学方程式:
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
②该反应还原剂是
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-
您最近半年使用:0次
2017-12-22更新
|
280次组卷
|
2卷引用:安徽省肥东县高级中学2020-2021学年高一上学期第二次月考化学试题
4 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_____ (填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的热稳定性强于亚硫酸
C.同浓度的氢硫酸和亚硫酸的pH为前者大于后者
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________ 、___________ ,制得等量H2所需能量较少的是_______ 。
(3)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
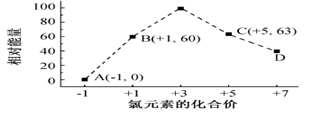
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的热稳定性强于亚硫酸
C.同浓度的氢硫酸和亚硫酸的pH为前者大于后者
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为
(3)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

①D是
②B→A+C反应的热化学方程式为
您最近半年使用:0次



