名校
解题方法
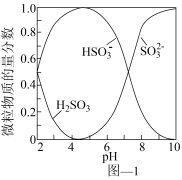
1 .  是一种重要的大气污染物。氨水、
是一种重要的大气污染物。氨水、 水悬浊液吸收烟气中
水悬浊液吸收烟气中 后经
后经 催化氧化,可得到某些硫酸盐。溶液中
催化氧化,可得到某些硫酸盐。溶液中 、
、 、
、 的物质的量分数随
的物质的量分数随 的分布如图1所示。
的分布如图1所示。
已知:室温下,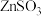 微溶于水,
微溶于水, 易溶于水;回答下列问题:
易溶于水;回答下列问题:
(1)氨水吸收 。向氨水中通入过量
。向氨水中通入过量 ,主要反应的离子方程式为
,主要反应的离子方程式为_______ ;当通入 至溶液
至溶液 时,溶液中大量存在的阴离子是
时,溶液中大量存在的阴离子是_______ (填化学式)。
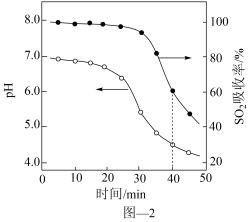
(2) 水悬浊液吸收
水悬浊液吸收 。向
。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的40min内,
,在开始吸收的40min内, 吸收率、溶液
吸收率、溶液 均经历了从几乎不变到迅速降低的变化(如图2),溶液
均经历了从几乎不变到迅速降低的变化(如图2),溶液 几乎不变阶段,主要产物是
几乎不变阶段,主要产物是_______ (填化学式); 吸收率迅速降低阶段,
吸收率迅速降低阶段, 也迅速降低的主要原因
也迅速降低的主要原因_______ ,该阶段主要反应的离子方程式为_______ 。若增大气体流速,会使 的吸收率
的吸收率_______ (填“增大”、“减小”或“不变”)。
(3) 催化氧化。其他条件相同时,调节吸收
催化氧化。其他条件相同时,调节吸收 得到溶液的
得到溶液的 在4.5~6.5范围内,该范围内
在4.5~6.5范围内,该范围内 越低
越低 生成速率越大,其主要原因是
生成速率越大,其主要原因是_______ ;随着氧化反应的进行,溶液的 将
将_______ (填“增大”、“减小”或“不变”)。
 是一种重要的大气污染物。氨水、
是一种重要的大气污染物。氨水、 水悬浊液吸收烟气中
水悬浊液吸收烟气中 后经
后经 催化氧化,可得到某些硫酸盐。溶液中
催化氧化,可得到某些硫酸盐。溶液中 、
、 、
、 的物质的量分数随
的物质的量分数随 的分布如图1所示。
的分布如图1所示。
已知:室温下,
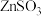 微溶于水,
微溶于水, 易溶于水;回答下列问题:
易溶于水;回答下列问题:(1)氨水吸收
 。向氨水中通入过量
。向氨水中通入过量 ,主要反应的离子方程式为
,主要反应的离子方程式为 至溶液
至溶液 时,溶液中大量存在的阴离子是
时,溶液中大量存在的阴离子是(2)
 水悬浊液吸收
水悬浊液吸收 。向
。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的40min内,
,在开始吸收的40min内, 吸收率、溶液
吸收率、溶液 均经历了从几乎不变到迅速降低的变化(如图2),溶液
均经历了从几乎不变到迅速降低的变化(如图2),溶液 几乎不变阶段,主要产物是
几乎不变阶段,主要产物是 吸收率迅速降低阶段,
吸收率迅速降低阶段, 也迅速降低的主要原因
也迅速降低的主要原因 的吸收率
的吸收率
(3)
 催化氧化。其他条件相同时,调节吸收
催化氧化。其他条件相同时,调节吸收 得到溶液的
得到溶液的 在4.5~6.5范围内,该范围内
在4.5~6.5范围内,该范围内 越低
越低 生成速率越大,其主要原因是
生成速率越大,其主要原因是 将
将
您最近一年使用:0次
2022-11-11更新
|
192次组卷
|
2卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
名校
2 . 油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量H2S)的侵蚀,生成PbS而变黑。可用一定量的H2O2溶液擦铁修复。完成下列填空:
(1)H2O2与PbS反应生成PbSO4的和H2O,写出该反应的化学方程式___________ 。
(2)在PbSO4的悬浊液中滴加一定量的CH3COONH4溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,该弱电解质的化学式为___________ 。当PbSO4和CH3COONH4恰好完全反应时,溶液显___________ 性(选填“酸性”、“中性”或“碱性”)。
(3)H2S为二元弱酸,向Na2S溶液中加入FeSO4溶液,生成FeS沉淀,还可能生成白色沉淀,其化学式为___________ ;该物质在空气中很快变为红褐色,原因是___________ 。
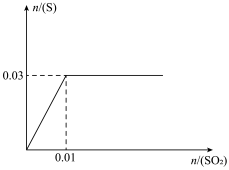
(4)向200mLH2S溶液中缓慢通入SO2,发生反应2H2S+SO2→3S +2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
+2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为___________ 。从开始通SO2至饱和,再继续通一段时间,整个过程中c(H+)的变化情况为___________ 。
(1)H2O2与PbS反应生成PbSO4的和H2O,写出该反应的化学方程式
(2)在PbSO4的悬浊液中滴加一定量的CH3COONH4溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,该弱电解质的化学式为
(3)H2S为二元弱酸,向Na2S溶液中加入FeSO4溶液,生成FeS沉淀,还可能生成白色沉淀,其化学式为
(4)向200mLH2S溶液中缓慢通入SO2,发生反应2H2S+SO2→3S
 +2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
+2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
您最近一年使用:0次
解题方法
3 . 写出符合下列要求的离子反应方程式。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:__ 。
(2)向NaHSO4溶液中滴加过量氢氧化钡溶液,离子反应方程式为:__ 。
(3)向1Llmol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液,离子反应方程式为:___ 。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO 还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为
还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为__ 。
(5)利用 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为__ 。
(6)Fe的一种含氧酸根FeO 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是__ 。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:
(2)向NaHSO4溶液中滴加过量氢氧化钡溶液,离子反应方程式为:
(3)向1Llmol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液,离子反应方程式为:
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO
 还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为
还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为(5)利用
 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为(6)Fe的一种含氧酸根FeO
 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
您最近一年使用:0次
4 . 某溶液中含有 、Na+、
、Na+、 、
、 、
、 、
、 、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
(1)离子浓度保持不变的是___________ ;
(2)离子浓度减小的是___________ ;
(3)离子浓度增大的是___________ ;
(4)其中发生的非氧化还原反应有___________ (用离子方程式表示);
(5)发生的氧化还原反应的有___________ (用离子方程式表示);。
 、Na+、
、Na+、 、
、 、
、 、
、 、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:(1)离子浓度保持不变的是
(2)离子浓度减小的是
(3)离子浓度增大的是
(4)其中发生的非氧化还原反应有
(5)发生的氧化还原反应的有
您最近一年使用:0次
5 . 酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
(1)酸雨是指pH_______ 的雨水。
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:① ;②
;②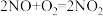 ;③
;③_______ 。
(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是_______ 。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_______ 。
③用氨水将SO2转化为NH4HSO3,再氧化成 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是_______ 、_______ (用离子方程式表示)。
(1)酸雨是指pH
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;② ;③
;③(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为
③用氨水将SO2转化为NH4HSO3,再氧化成
 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是
您最近一年使用:0次
2021-02-07更新
|
171次组卷
|
2卷引用:山西省大同市灵丘一中、广灵一中2020-2021学年高一下学期期中联考化学试题
解题方法
6 . (1)在一定条件下,可以用H2O2氧化H2S。随着参加反应的 变化,氧化产物不同,当
变化,氧化产物不同,当 =4时,氧化产物的分子式为
=4时,氧化产物的分子式为________ 。
(2)利用废铁屑制备聚合硫酸铁的过程中,需要向反应釜中加入氧化剂氧化Fe2+,最合适的是________ 。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为______________ 。
(4)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________ 。
(5)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式___________ 。
(6)NH3在催化剂条件下还原NO2生成N2和H2O的化学方程式:_________________ 。
 变化,氧化产物不同,当
变化,氧化产物不同,当 =4时,氧化产物的分子式为
=4时,氧化产物的分子式为(2)利用废铁屑制备聚合硫酸铁的过程中,需要向反应釜中加入氧化剂氧化Fe2+,最合适的是
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为(4)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
(5)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(6)NH3在催化剂条件下还原NO2生成N2和H2O的化学方程式:
您最近一年使用:0次
解题方法
7 . 资料显示: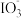 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
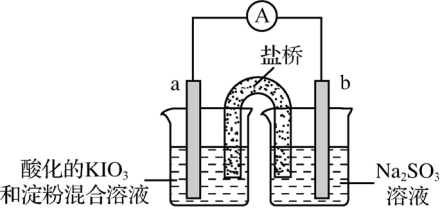
①甲同学在b电极附近的溶液中检测出了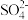
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
名校
8 . 化学还原法是处理含Cr2O 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
Cr2O
 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
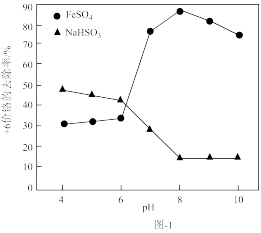
①在酸性条件下,请写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___ 。
②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.___ 。
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。
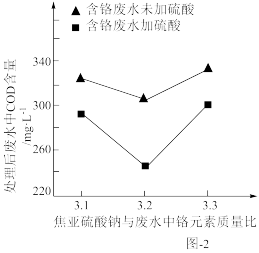
①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是___ 。
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是___ 。
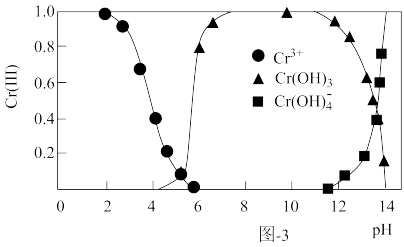
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在___ ;若pH过高,溶液中残留铬量增大,其原因为___ 。
 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:Cr2O

 Cr3+
Cr3+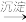 Cr(OH)3
Cr(OH)3已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O
 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。

①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在

您最近一年使用:0次
2020-11-19更新
|
485次组卷
|
5卷引用:江苏省无锡市2021届高三上学期期中考试化学(选修)试题
江苏省无锡市2021届高三上学期期中考试化学(选修)试题江苏省无锡市2020-2021学年高三上学期期中考试化学试题江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题(已下线)化学-2023年高考押题预测卷01(江苏卷)(含考试版、全解全析、参考答案、答题卡)江苏省前黄高级中学2022-2023学年高三下学期二模适应性考试化学试题



