解题方法
1 . 写出符合下列要求的离子反应方程式。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:__ 。
(2)向NaHSO4溶液中滴加过量氢氧化钡溶液,离子反应方程式为:__ 。
(3)向1Llmol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液,离子反应方程式为:___ 。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO 还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为
还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为__ 。
(5)利用 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为__ 。
(6)Fe的一种含氧酸根FeO 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是__ 。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:
(2)向NaHSO4溶液中滴加过量氢氧化钡溶液,离子反应方程式为:
(3)向1Llmol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液,离子反应方程式为:
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO
 还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为
还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为(5)利用
 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为(6)Fe的一种含氧酸根FeO
 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
您最近一年使用:0次
2 . (NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用如图所示装置进行实验(夹持和加热装置略)。
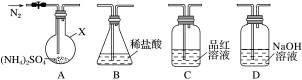
连接装置A→D→B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO ,无SO
,无SO 。进一步研究发现,气体产物中无氮氧化物。
。进一步研究发现,气体产物中无氮氧化物。
检验装置D内溶液中有SO ,无SO
,无SO 的实验操作和现象是
的实验操作和现象是___ 。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用如图所示装置进行实验(夹持和加热装置略)。

连接装置A→D→B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO
 ,无SO
,无SO 。进一步研究发现,气体产物中无氮氧化物。
。进一步研究发现,气体产物中无氮氧化物。检验装置D内溶液中有SO
 ,无SO
,无SO 的实验操作和现象是
的实验操作和现象是
您最近一年使用:0次
解题方法
3 . 硫的多种化合物在工业中有重要的应用。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1∶2时,氧化产物为___________ (填化学式)。
②将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2.该反应的化学方程式为___________ 。
(2)铬会造成环境污染。某酸性废水中含有Cr2O ,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O
,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O 转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为___________ 。
②处理后的废水中Cr3+的物质的量浓度为___________ mol·L-1。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1∶2时,氧化产物为
②将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2.该反应的化学方程式为
(2)铬会造成环境污染。某酸性废水中含有Cr2O
 ,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O
,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O 转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。①Na2S2O5参加反应的离子方程式为
②处理后的废水中Cr3+的物质的量浓度为
您最近一年使用:0次
名校
4 . 钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是____ 。
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式______ 。
ClO + VO2++ = Cl-+ VO
+ VO2++ = Cl-+ VO +
+
(3) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是____ 。
(4)在20.00 mL 0.1 mol.L-1 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 ___ 。
a.VO2+ b. c. V2+ d.V
c. V2+ d.V
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式
ClO
 + VO2++ = Cl-+ VO
+ VO2++ = Cl-+ VO +
+ (3) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是(4)在20.00 mL 0.1 mol.L-1
 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 a.VO2+ b.
 c. V2+ d.V
c. V2+ d.V
您最近一年使用:0次
2021-01-31更新
|
660次组卷
|
4卷引用:安徽省合肥市2021年高三第一次教学质量检测化学试题
安徽省合肥市2021年高三第一次教学质量检测化学试题(已下线)热点10 氧化还原反应与电极反应-2021年高考化学【热点·重点·难点】专练(新高考)山东省泰安市宁阳县第四中学2022-2023学年高三上学期10月月考化学试题(等级考)山东省泰安市宁阳县第四中学2023-2024学年高三上学期10月月考化学试题
20-21高一上·江苏连云港·期末
解题方法
5 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是___________ (用化学方程式表示)。
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:___________ 。
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为: 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是___________ 。
②空气样品中SO2的体积分数为___________ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
随着时间的推移,pH逐渐变小的原因是
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为:
 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
2021-01-27更新
|
457次组卷
|
3卷引用:专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练
(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题
名校
6 . 化学还原法是处理含Cr2O 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
Cr2O
 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
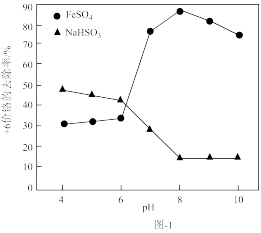
(1)取含Cr2O 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___ 。
②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.___ 。
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。
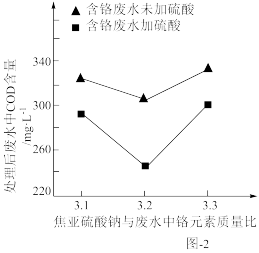
①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是___ 。
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是___ 。
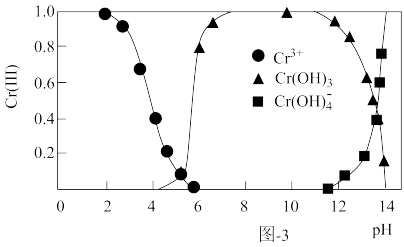
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在___ ;若pH过高,溶液中残留铬量增大,其原因为___ 。
 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:Cr2O

 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O
 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。

①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在

您最近一年使用:0次
2020-11-19更新
|
485次组卷
|
5卷引用:江苏省无锡市2020-2021学年高三上学期期中考试化学试题
江苏省无锡市2020-2021学年高三上学期期中考试化学试题江苏省无锡市2021届高三上学期期中考试化学(选修)试题江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题(已下线)化学-2023年高考押题预测卷01(江苏卷)(含考试版、全解全析、参考答案、答题卡)江苏省前黄高级中学2022-2023学年高三下学期二模适应性考试化学试题
16-17高三上·天津静海·开学考试
解题方法
7 . 易混易错题组:离子方程式的书写
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为______________ 。
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式__________________ 。
(学法题)书写此类离子方程式的关键是,抓住______________ 量物质。
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为___________________ 。
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:____________ 。
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的__________ 顺序。
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为_________________ 。
②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为___________________________ 。
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是_______________ 。
④对比②和③实验所得的结果,将I2、ClO-、 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为___________ 。
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式
(学法题)书写此类离子方程式的关键是,抓住
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将
 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是
④对比②和③实验所得的结果,将I2、ClO-、
 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为
您最近一年使用:0次



