解题方法
1 . 煤是一种常用的燃料。煤燃烧产生的废气中含有的二氧化硫等有害气体会对环境造成污染,因此需要将废气净化后再排放。
(1)这些废气会对环境造成怎样的影响?__________
(2)如果废气中的二氧化硫进入大气,会发生哪些化学变化?写出相关反应的化学方程式。__________
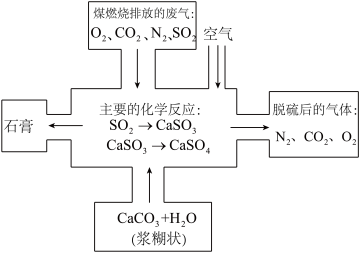
(3)如图是对煤燃烧产生的废气进行脱硫处理的基本流程图,试写出废气脱硫过程中发生的主要反应的化学方程式。__________

(1)这些废气会对环境造成怎样的影响?
(2)如果废气中的二氧化硫进入大气,会发生哪些化学变化?写出相关反应的化学方程式。
(3)如图是对煤燃烧产生的废气进行脱硫处理的基本流程图,试写出废气脱硫过程中发生的主要反应的化学方程式。
您最近半年使用:0次
解题方法
2 . 将二氧化硫的水溶液在空气中放置一段时间后,在溶液中能检测到硫酸根离子的存在,且溶液的 变小,试说明其原因
变小,试说明其原因____ 。
 变小,试说明其原因
变小,试说明其原因
您最近半年使用:0次
解题方法
3 . 硫酸厂的烟道气会严重污染环境,为保护环境、变废为宝,有多种脱硫方案,如石灰石-石膏法、氨水法、活性炭法、氧化镁法等。请写出下列反应的化学方程式。
(1)二氧化硫与熟石灰反应_______ 。
(2)亚硫酸钙(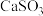 )与氧气反应
)与氧气反应_______ 。
(3)二氧化硫与氨水反应_______ 。
(4)亚硫酸铵与氧气反应_______ 。
(1)二氧化硫与熟石灰反应
(2)亚硫酸钙(
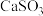 )与氧气反应
)与氧气反应(3)二氧化硫与氨水反应
(4)亚硫酸铵与氧气反应
您最近半年使用:0次
2021高一·全国·专题练习
4 . 回答下列问题:
(1)我国酸雨危害十分严重,是世界三大酸雨地区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中___________ 含量超标,主要反应的化学方程式为
途径一:___________ ;
途径二:___________ 。
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
请根据上述材料,回答下列有关问题:
酸雨放置时,pH发生变化的主要原因为___________ 。
(3)你认为减少酸雨产生的途径可采取的措施是___________(填字母)。
(1)我国酸雨危害十分严重,是世界三大酸雨地区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中
途径一:
途径二:
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 | 开始 | 8 h后 | 16 h后 | 24 h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 |
请根据上述材料,回答下列有关问题:
酸雨放置时,pH发生变化的主要原因为
(3)你认为减少酸雨产生的途径可采取的措施是___________(填字母)。
| A.用煤作燃料 | B.把工厂烟囱造高 |
| C.燃料脱硫 | D.开发新能源 |
您最近半年使用:0次
解题方法
5 . 图1是自然界中硫元素的存在示意图,图2表示硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
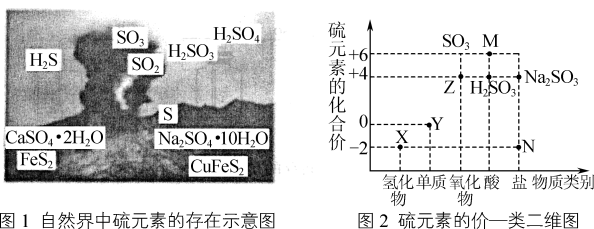
(1)图1中能与水反应生成强酸的物质的化学式为___________ 。
(2)煤的燃烧会产生大量SO2造成环境污染,下列关于SO2治理措施不可行的是___________(填字母)。
(3)Cu和M的浓溶液反应生成Z的化学方程式为___________ 。
(4)Na2SO3溶液易变质,实验室验证Na2SO3溶液已变质的操作和现象是___________ 。

(1)图1中能与水反应生成强酸的物质的化学式为
(2)煤的燃烧会产生大量SO2造成环境污染,下列关于SO2治理措施不可行的是___________(填字母)。
| A.在燃煤中添加生石灰固硫 | B. SO2 |
| C.将煤燃烧产生的尾气排放到高空 | D.用氨水吸收烟气中的SO2 |
(4)Na2SO3溶液易变质,实验室验证Na2SO3溶液已变质的操作和现象是
您最近半年使用:0次
解题方法
6 . 写出符合下列要求的离子反应方程式。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:__ 。
(2)向NaHSO4溶液中滴加过量氢氧化钡溶液,离子反应方程式为:__ 。
(3)向1Llmol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液,离子反应方程式为:___ 。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO 还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为
还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为__ 。
(5)利用 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为__ 。
(6)Fe的一种含氧酸根FeO 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是__ 。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:
(2)向NaHSO4溶液中滴加过量氢氧化钡溶液,离子反应方程式为:
(3)向1Llmol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液,离子反应方程式为:
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO
 还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为
还原为N2,一段时间后溶液碱性明显增强。上述反应的离子方程式为(5)利用
 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为(6)Fe的一种含氧酸根FeO
 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
您最近半年使用:0次
21-22高一·全国·课时练习
7 . Na2SO3中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、H2SO4、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有___________ ,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有
您最近半年使用:0次
8 . 某溶液中含有 、Na+、
、Na+、 、
、 、
、 、
、 、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
(1)离子浓度保持不变的是___________ ;
(2)离子浓度减小的是___________ ;
(3)离子浓度增大的是___________ ;
(4)其中发生的非氧化还原反应有___________ (用离子方程式表示);
(5)发生的氧化还原反应的有___________ (用离子方程式表示);。
 、Na+、
、Na+、 、
、 、
、 、
、 、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:(1)离子浓度保持不变的是
(2)离子浓度减小的是
(3)离子浓度增大的是
(4)其中发生的非氧化还原反应有
(5)发生的氧化还原反应的有
您最近半年使用:0次
9 . 硫和硒(34Se)在元素周期表中位于同一主族,均是生产生活中重要的非金属元素。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是___________ 。
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:___________ 。
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)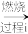 SeO2
SeO2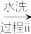 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒
①下列说法正确的是___________ (填字母序号)。
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)
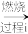 SeO2
SeO2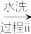 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒①下列说法正确的是
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为
您最近半年使用:0次
20-21高二上·上海·课时练习
解题方法
10 . 将下列溶液分别蒸干并灼烧,最后分别得到什么固体?如何解释?
(1)Na2CO3___ ;
(2)NaHCO3___ ;
(3)CuSO4___ ;
(4)CuCl2___ ;
(5)Na2SO3___ ;
(6)Na2SO4___ ;
(7)FeCl2___ ;
(8)FeCl3___ ;
(9)Fe2(SO4)3___ 。
(1)Na2CO3
(2)NaHCO3
(3)CuSO4
(4)CuCl2
(5)Na2SO3
(6)Na2SO4
(7)FeCl2
(8)FeCl3
(9)Fe2(SO4)3
您最近半年使用:0次



