硫和硒(34Se)在元素周期表中位于同一主族,均是生产生活中重要的非金属元素。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是___________ 。
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:___________ 。
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)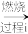 SeO2
SeO2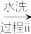 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒
①下列说法正确的是___________ (填字母序号)。
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)
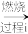 SeO2
SeO2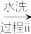 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒①下列说法正确的是
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为
更新时间:2021-10-30 09:02:34
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求填空:
(1)FeO·Cr2O3+NaNO3 Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________ ,该反应的氧化产物为_____________ ,该步骤不能使陶瓷容器,用反应式说明:_________ 。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________ 。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________ 。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________ 。
(1)FeO·Cr2O3+NaNO3
 Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为(2)完成下列反应
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是
(5)用离子反应方程式表示泡沫灭火器的反应原理:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】据2020年9月15日新闻联播报道,欧洲南方天文台的天文专家团队在金星大气层中探测到磷化氢(PH3)气体。磷化氢是一种无色气体,极毒、有鱼腥臭气味。磷化氢的化学性质活泼,极易与氧气、氯气等发生剧烈反应,在温度高于500℃时分解为两种单质。
(1)从“磷化氢的化学性质活泼,极易与氧气、氯气等发生剧烈反应”的描述中可知,磷化氢具有_____ (“氧化性”“还原性”或“氧化性和还原性”)。
(2)实验室中可以用白磷与浓氢氧化钾共热制取磷化氢,反应的化学方程式如下:P4+3KOH(浓)+3H2O PH3↑+3KH2PO2
PH3↑+3KH2PO2
①KH2PO2中P元素的化合价是______ 。
②上述反应中,氧化剂与还原剂的质量比为______ ;氧化产物与还原产物的物质的量之比为______ 。用双线桥表示该反应电子转移的方向和数目_________ ;P4+3KOH(浓)+3H2O=PH3↑+3KH2PO2;若有124g白磷参与反应,则转移电子的数目为______ (NA表示阿伏加德罗常数的值);
③H3PO2与过量的KOH溶液反应生成KH2PO2,则H3PO2为______ 元酸。H3PO2是一种弱酸,写出H3PO2与过量的KOH溶液反应的离子方程式________ 。
(1)从“磷化氢的化学性质活泼,极易与氧气、氯气等发生剧烈反应”的描述中可知,磷化氢具有
(2)实验室中可以用白磷与浓氢氧化钾共热制取磷化氢,反应的化学方程式如下:P4+3KOH(浓)+3H2O
 PH3↑+3KH2PO2
PH3↑+3KH2PO2①KH2PO2中P元素的化合价是
②上述反应中,氧化剂与还原剂的质量比为
③H3PO2与过量的KOH溶液反应生成KH2PO2,则H3PO2为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】工业烟道气中含有的二氧化硫和氮氧化物是大气主要污染物,脱硫脱氮是环境治理的热点问题。回答下列问题:
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,__________ (在“□”里填入系数,在“__”上填入微粒符号),加入CaCO3可以提高SO2去除率,原因是________ 。
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
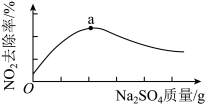
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是________ 。
(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为________ 。
②滴定过程中主要使用的玻璃仪器有________ 和锥形瓶等。
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为________ mg·m−3。
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是

(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为
②滴定过程中主要使用的玻璃仪器有
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。某小组同学验证SO2的性质。装置如图所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(1)瓶盖___ (填字母)中的实验现象能证明SO2具有还原性,并写出反应的离子方程式___ 。
(2)瓶盖B中的现象证明SO2具有的性质是___ ;瓶盖C中发生反应的化学方程式为___ 。
(3)瓶盖C中无明显变化,若要证明C中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是___ (填字母)。
a.石蕊溶液 b.NaCl溶液
(4)将SO2气体通入H2S的水溶液中,生成淡黄色的浑浊,证明SO2具有的性质是___ ;写出反应的化学方程式___ 。
| 实验装置 | 瓶盖 | 物质 | 实验现象 |
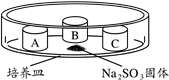 | A | KMnO4酸性溶液 | 溶液褪色 |
| B | 蘸有品红溶液的棉花 | 品红溶液褪色 | |
| C | 蒸馏水 | 无明显变化 |
已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(1)瓶盖
(2)瓶盖B中的现象证明SO2具有的性质是
(3)瓶盖C中无明显变化,若要证明C中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是
a.石蕊溶液 b.NaCl溶液
(4)将SO2气体通入H2S的水溶液中,生成淡黄色的浑浊,证明SO2具有的性质是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】SO2是重要的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。
(1)向食品中添加适量的SO2可以起到防腐、漂白、抗氧化的作用,则葡萄酒中添加适量的SO2的作用是____ 。
(2)SO2性质多变,若将SO2气体通入H2S溶液中,能观察到的现象为______ ,该反应中SO2表现出_______ 性;若将SO2气体通入品红溶液中,能观察到现象为_____ ,该反应中SO2表现出_______ 性。
(3)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成 而实现SO2的回收利用。写出Fe3+将SO2氧化成
而实现SO2的回收利用。写出Fe3+将SO2氧化成 反应的离子方程式:
反应的离子方程式:_______ 。
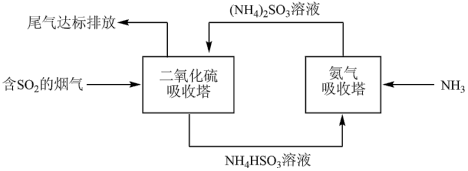
(4)SO2有毒,且能形成酸雨,是大气主要污染物之一。某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。“氨气吸收塔”中发生反应的化学方程式为_______ ,该流程中可循环利用的物质为_______ (填化学式)。
(1)向食品中添加适量的SO2可以起到防腐、漂白、抗氧化的作用,则葡萄酒中添加适量的SO2的作用是
(2)SO2性质多变,若将SO2气体通入H2S溶液中,能观察到的现象为
(3)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成
 而实现SO2的回收利用。写出Fe3+将SO2氧化成
而实现SO2的回收利用。写出Fe3+将SO2氧化成 反应的离子方程式:
反应的离子方程式:(4)SO2有毒,且能形成酸雨,是大气主要污染物之一。某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。“氨气吸收塔”中发生反应的化学方程式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】卤族元素在性质上具有相似性与递变性。为了验证卤族部分元素递变规律,设计如图装置进行实验。请回答下列问题。
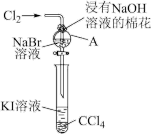
(1)A中发生反应的化学方程式是_______ 。
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是_______ 。
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为_______ 。
(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱_______ 。
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为_______ 。
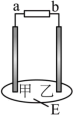
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是
(8)下图是用强光照射广口瓶中新制氯水时传感器所获得数据的图像,下列各项代表纵坐标的物理量,其中与图像不相符的是

(9)下列变化不需要破坏化学键的是

(1)A中发生反应的化学方程式是
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
| A.Cl-、Br-、I-的还原性逐渐增强 | B.Cl2、Br2、I2的熔点逐渐升高 |
| C.HCl、HBr、HI的酸性逐渐减弱 | D.HCl、HBr、HI的稳定性逐渐减弱 |
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应
 填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是

| A.b是阳极,a是阴极 | B.a是正极,b是负极 |
| C.乙是正极,甲是负极 | D.乙是阳极,甲是阴极 |

| A.溶液中氯离子的浓度 | B.溶液的 pH |
| C.瓶中氧气的体积分数 | D.溶液的导电能力 |
| A.液态水变为水蒸气 | B.HCl 气体溶于水 |
| C.NaHCO3 受热分解 | D.NaCl 熔化 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】下表是元素周期表的一部分元素,用元素符号或化学式回答下列问题:
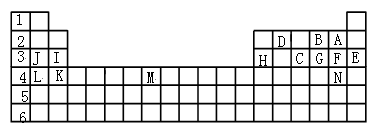
① 表中用字母标出的14种元素中,化学性质最不活泼的是________ ,主族元素中金属性最强的是_______ ,常温下单质为液态的非金属元素是_______ ;属于过渡元素的是_________ 。
②C、G、F气态氢化物的稳定性顺序是______________________ 。
③第三周期中原子半径最小的元素是_______ 。

① 表中用字母标出的14种元素中,化学性质最不活泼的是
②C、G、F气态氢化物的稳定性顺序是
③第三周期中原子半径最小的元素是
您最近一年使用:0次
【推荐3】原子或离子半径的比较方法
(1)同种元素的离子半径:阴离子_______ 于原子,原子_______ 于阳离子,低价阳离子_______ 于高价阳离子。例如:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。
(2)能层结构相同的离子:核电荷数越_______ ,半径越_______ 。例如:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
(3)带相同电荷的离子:能层数越_______ ,半径越_______ 。例如:r(Li+)<r(Na+)<r(K+)_______ r(Rb+)<r(Cs+),r(O2-)<r(S2-) _______ (Se2-)<r(Te2-)。
(4)核电荷数、能层数均不同的离子:可选一种离子参照比较。例如:比较r(K+)与r(Mg2+),可选r(Na+)为参照,r(K+)_______ r(Na+) _______ r(Mg2+)。
(1)同种元素的离子半径:阴离子
(2)能层结构相同的离子:核电荷数越
(3)带相同电荷的离子:能层数越
(4)核电荷数、能层数均不同的离子:可选一种离子参照比较。例如:比较r(K+)与r(Mg2+),可选r(Na+)为参照,r(K+)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】资料显示: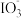 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
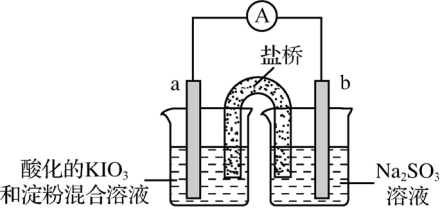
①甲同学在b电极附近的溶液中检测出了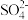
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
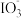 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
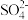
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是______ 。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2____ kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 _______ 。
联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】依据图中硫元素及其化合物的转化关系,回答问题:
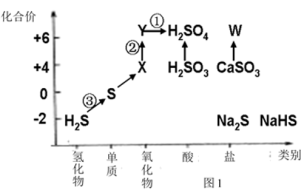
(1)图中,请写出反应①的离子方程式___________ 。
(2)图中,X的化学式为___________ ,从化合价上看,X具有___________ (填数字)
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有___________ (填数字)。
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为___________ mol。也可表示为2H2S+SO2=3S↓+2H2O,当生成1molS时,转移的电子为___________ mol。
(5)SO2可使酸性高锰酸钾溶液褪色,体现了___________ (填数字)
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:___________ 。

(1)图中,请写出反应①的离子方程式
(2)图中,X的化学式为
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为
(5)SO2可使酸性高锰酸钾溶液褪色,体现了
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:
您最近一年使用:0次



