21-22高一·全国·课时练习
1 . Na2SO3中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、H2SO4、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有___________ ,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有
您最近一年使用:0次
2 . I.利用下图装置制备 ,并研究
,并研究 的性质。
的性质。
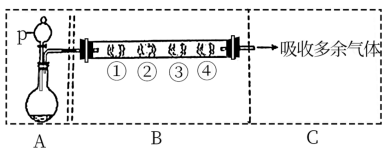
(1)A装置利用亚硫酸钠和硫酸反应制备 ,写出化学方程式
,写出化学方程式_______ 。
(2)填写下表
(3) 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性_______ (填“增强”“减弱”“不变”)原因是_______ (用化学方程式表示)。
II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(4)上述流程中,加入 后,发生反应的化学方程式为
后,发生反应的化学方程式为_______ 。
(5)亚硫酸钠粗品中含有少量 ,原因是
,原因是_______ 。
 ,并研究
,并研究 的性质。
的性质。
(1)A装置利用亚硫酸钠和硫酸反应制备
 ,写出化学方程式
,写出化学方程式(2)填写下表
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
体现 的性质 的性质 |
(3)
 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
(4)上述流程中,加入
 后,发生反应的化学方程式为
后,发生反应的化学方程式为(5)亚硫酸钠粗品中含有少量
 ,原因是
,原因是
您最近一年使用:0次
解题方法
3 . 依据图中硫元素及其化合物的转化关系,回答问题:
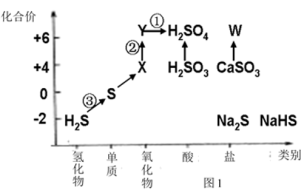
(1)图中,请写出反应①的离子方程式___________ 。
(2)图中,X的化学式为___________ ,从化合价上看,X具有___________ (填数字)
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有___________ (填数字)。
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为___________ mol。也可表示为2H2S+SO2=3S↓+2H2O,当生成1molS时,转移的电子为___________ mol。
(5)SO2可使酸性高锰酸钾溶液褪色,体现了___________ (填数字)
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:___________ 。

(1)图中,请写出反应①的离子方程式
(2)图中,X的化学式为
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为
(5)SO2可使酸性高锰酸钾溶液褪色,体现了
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:
您最近一年使用:0次
4 . (1)①写出金刚砂的化学式___ ;②写出葡萄糖的结构简式___ 。
(2)CH3ONa是离子化合物,各原子均满足8电子稳定结构(除H以外),CH3ONa的电子式是___ 。
(3)写出向NaHSO3溶液加入少量Na2O2的离子方程式__ 。
(2)CH3ONa是离子化合物,各原子均满足8电子稳定结构(除H以外),CH3ONa的电子式是
(3)写出向NaHSO3溶液加入少量Na2O2的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并用单线桥标明电子转移的方向和数目:_______ 。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______ ,则发生了钝化;若铁棒表面_______ ,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示):_______ 。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:_______ 。
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并用单线桥标明电子转移的方向和数目:
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示):
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:
您最近一年使用:0次
6 . 写出下列反应的化学方程式,是离子反应的写离子方程式
(1)工业上制备氨气反应的化学方程式___________
(2)铜和浓硫酸发生反应的化学方程式___________
(3)氨气催化氧化生成一氧化氮的化学方程式___________
(4)工业上制备漂白液发生反应的离子方程式___________
(5)将亚硫酸钠溶液滴入酸性高锰酸钾溶液中发生反应的离子方程式___________
(1)工业上制备氨气反应的化学方程式
(2)铜和浓硫酸发生反应的化学方程式
(3)氨气催化氧化生成一氧化氮的化学方程式
(4)工业上制备漂白液发生反应的离子方程式
(5)将亚硫酸钠溶液滴入酸性高锰酸钾溶液中发生反应的离子方程式
您最近一年使用:0次
解题方法
7 . (1)写出丙烷的结构简式:_______ 。
(2)写出亚硫酸钠在空气中被氧化的化学方程式:_______
(2)写出亚硫酸钠在空气中被氧化的化学方程式:
您最近一年使用:0次
解题方法
8 . 某待测溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种和一种常见金属阳离子(
中的若干种和一种常见金属阳离子( ),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
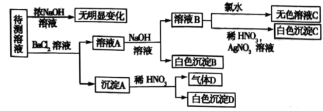
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
(2)待测溶液中是否有 、
、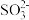 ?
?_______ 。
(3)形成沉淀B时反应的离子方程式为_______ 。
(4)形成沉淀C时反应的离子方程式为_______ 。
(5)若气体D遇空气变红棕色,则该反应的化学方程式为_______ 。
 、
、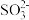 、
、 、
、 、
、 、
、 、
、 中的若干种和一种常见金属阳离子(
中的若干种和一种常见金属阳离子( ),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 |
 、
、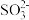 ?
?(3)形成沉淀B时反应的离子方程式为
(4)形成沉淀C时反应的离子方程式为
(5)若气体D遇空气变红棕色,则该反应的化学方程式为
您最近一年使用:0次
2021-02-16更新
|
684次组卷
|
2卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 章末综合检测卷
9 . 酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
(1)酸雨是指pH_______ 的雨水。
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:① ;②
;②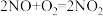 ;③
;③_______ 。
(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是_______ 。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_______ 。
③用氨水将SO2转化为NH4HSO3,再氧化成 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是_______ 、_______ (用离子方程式表示)。
(1)酸雨是指pH
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;②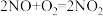 ;③
;③(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为
③用氨水将SO2转化为NH4HSO3,再氧化成
 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是
您最近一年使用:0次
2021-02-07更新
|
171次组卷
|
2卷引用:广西河池市2020-2021学年高一上学期期末教学质量检测化学试题
解题方法
10 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是___________ (用化学方程式表示)。
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:___________ 。
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为: 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是___________ 。
②空气样品中SO2的体积分数为___________ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
随着时间的推移,pH逐渐变小的原因是
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为:
 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
2021-01-27更新
|
457次组卷
|
3卷引用:江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题
江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题



