解题方法
1 . 某研究性学习小组欲用下图所示的装置证明H2SO3和HClO酸性强弱(已知:H2SO3酸性强于H2CO3)。下列有关说法不正确的是
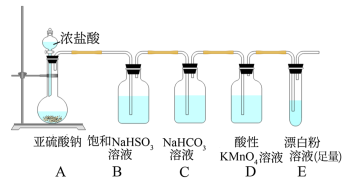

| A.通过本实验无法得出非金属性:Cl>S |
| B.装置B的作用是除去SO2中混入的HCl气体 |
| C.可直接将SO2通入Ca(ClO)2溶液来证明H2SO3和HClO酸性强弱 |
| D.装置D颜色变浅但不褪色,且E中产生白色沉淀即可证明H2SO3酸性强于HClO |
您最近一年使用:0次
2021-09-14更新
|
444次组卷
|
3卷引用:湖北省新高考联考协作体2021-2022学年高二上学期开学考试化学试题
湖北省新高考联考协作体2021-2022学年高二上学期开学考试化学试题(已下线)专题5 微观结构与物质的多样性(章末培优)-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)河南省顶级名校2021-2022学年高一下学期5月月考化学试题
解题方法
2 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用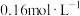
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有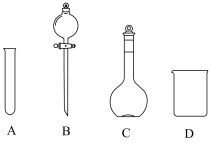
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用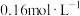
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
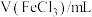 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
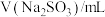 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近一年使用:0次
名校
解题方法
3 . 下列实验操作不能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 向生石灰中滴加浓氨水、气体通过碱石灰 | 制备少量 |
| B | 以惰性材料为电极,电解同浓度的 和 和 混合液 混合液 | 证明氧化性: |
| C | 向 溶液中加入硫酸,将产生的气体通入溴水中 溶液中加入硫酸,将产生的气体通入溴水中 | 证明 由+6价 由+6价 价 价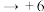 价转化 价转化 |
| D | 在苯酚溶液中滴加浓溴水 | 证明苯酚能与溴发生化学反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 实验室用浓硫酸与铜丝加热生成的 制备少量
制备少量 并检验性质。
并检验性质。 并检验性质
并检验性质
操作及现象:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,试管ⅲ中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。
(1)ⅰ中发生反应的化学方程式为_______ 。
(2)ⅱ中现象说明 具有
具有_______ 作用。
(3)若将试管ⅲ与试管ⅱ位置互换,石蕊溶液变为红色能否作为 是酸性氧化物的证据?说明理由:
是酸性氧化物的证据?说明理由:_______ 。
Ⅱ.制备 并检验性质
并检验性质
(4)ⅳ中反应的离子方程式为_______ 。
(5)进行实验: 具有
具有_______ 性。
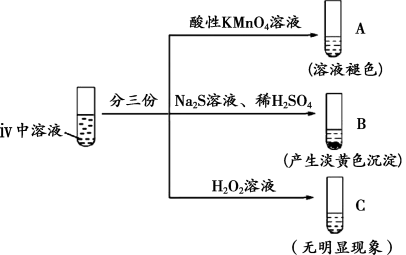
②B中产生淡黄色沉淀的离子方程式为_______ 。
③C中无明显现象,甲同学通过检测 的生成证明
的生成证明 和
和 发生反应:取1
发生反应:取1 C中溶液于试管中,
C中溶液于试管中,_______ (填试剂和操作),产生白色沉淀。
乙同学认为甲同学的实验没有排除 的影响,设计对比实验:
的影响,设计对比实验:_______ 。
综合甲、乙同学的实验可知, 能将
能将 氧化。
氧化。
 制备少量
制备少量 并检验性质。
并检验性质。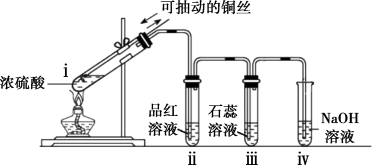
 并检验性质
并检验性质操作及现象:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,试管ⅲ中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。
(1)ⅰ中发生反应的化学方程式为
(2)ⅱ中现象说明
 具有
具有(3)若将试管ⅲ与试管ⅱ位置互换,石蕊溶液变为红色能否作为
 是酸性氧化物的证据?说明理由:
是酸性氧化物的证据?说明理由:Ⅱ.制备
 并检验性质
并检验性质(4)ⅳ中反应的离子方程式为
(5)进行实验:
 具有
具有②B中产生淡黄色沉淀的离子方程式为
③C中无明显现象,甲同学通过检测
 的生成证明
的生成证明 和
和 发生反应:取1
发生反应:取1 C中溶液于试管中,
C中溶液于试管中,乙同学认为甲同学的实验没有排除
 的影响,设计对比实验:
的影响,设计对比实验:综合甲、乙同学的实验可知,
 能将
能将 氧化。
氧化。
您最近一年使用:0次
2022-07-10更新
|
741次组卷
|
4卷引用:北京朝阳区2021-2022学年高一下学期期末考试化学试题
5 . 某小组通过实验探究NO的某些性质。
(1)从氮元素的价态角度分析,NO有_____ 性。
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为______ 。
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O 。
。
ⅱ.Ag+与N2O 反应生成黄色沉淀。
反应生成黄色沉淀。
①检验SO 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,_____ (填操作和实验现象)。
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,_____ (填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是_____ 。
③写出NO与碱性Na2SO3溶液反应的离子方程式______ 。
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
氧化反应:_____ 。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:_____ 。
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是_____ 。
②再向生成的溶液中加入一定量_____ ,以此溶液来吸收NO气体。
(1)从氮元素的价态角度分析,NO有
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O
 。
。ⅱ.Ag+与N2O
 反应生成黄色沉淀。
反应生成黄色沉淀。①检验SO
 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,
上述实验证明NO有氧化性。
实验Ⅱ的目的是
③写出NO与碱性Na2SO3溶液反应的离子方程式
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O

氧化反应:
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是
②再向生成的溶液中加入一定量
您最近一年使用:0次
2022-01-17更新
|
411次组卷
|
3卷引用:北京市石景山区2021-2022学年高三上学期期末考试化学试题
北京市石景山区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题
名校
6 . 煤是我国重要的化石燃料。
(1)煤液化过程中产生的 可生产硫酸,部分过程如图所示:
可生产硫酸,部分过程如图所示:
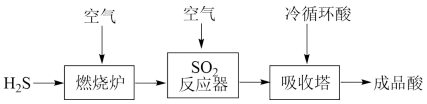
 反应器中的化学方程式是
反应器中的化学方程式是_______ 。
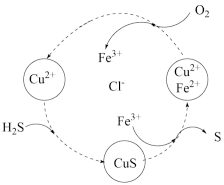
(2) 还可用于回收单质硫,转化如图所示。其中化合价保持不变的元素有
还可用于回收单质硫,转化如图所示。其中化合价保持不变的元素有_______ ,该图示总反应的化学方程式为_______ 。
(3)煤燃烧产生的废气中含有 ,可以用工业废碱渣(主要成分为
,可以用工业废碱渣(主要成分为 )来吸收,还可以得到亚硫酸钠(
)来吸收,还可以得到亚硫酸钠(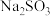 )粗品。其流程如图:
)粗品。其流程如图:
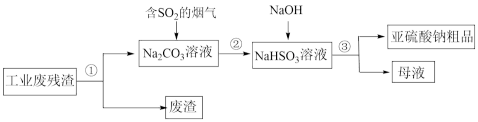
①上述流程中,加入NaOH后,发生反应的化学方程式为_______ 。
②亚硫酸钠粗品中含有少量 ,设计实验证明亚硫酸钠粗品含有少量
,设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______ ,出现白色沉淀,则证明含有 。
。
(4)已知有VL(已换算成标准状况)尾气,通入足量 吸收再加足量
吸收再加足量 溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到bg沉淀。
溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到bg沉淀。 吸收
吸收 的化学方程式是
的化学方程式是_______ ;尾气中 的含量(体积分数)的计算式是
的含量(体积分数)的计算式是_______ 。
(1)煤液化过程中产生的
 可生产硫酸,部分过程如图所示:
可生产硫酸,部分过程如图所示:
 反应器中的化学方程式是
反应器中的化学方程式是(2)
 还可用于回收单质硫,转化如图所示。其中化合价保持不变的元素有
还可用于回收单质硫,转化如图所示。其中化合价保持不变的元素有
(3)煤燃烧产生的废气中含有
 ,可以用工业废碱渣(主要成分为
,可以用工业废碱渣(主要成分为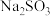 )来吸收,还可以得到亚硫酸钠(
)来吸收,还可以得到亚硫酸钠(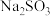 )粗品。其流程如图:
)粗品。其流程如图:
①上述流程中,加入NaOH后,发生反应的化学方程式为
②亚硫酸钠粗品中含有少量
 ,设计实验证明亚硫酸钠粗品含有少量
,设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。(4)已知有VL(已换算成标准状况)尾气,通入足量
 吸收再加足量
吸收再加足量 溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到bg沉淀。
溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到bg沉淀。 吸收
吸收 的化学方程式是
的化学方程式是 的含量(体积分数)的计算式是
的含量(体积分数)的计算式是
您最近一年使用:0次
2021-12-30更新
|
954次组卷
|
3卷引用:福建省厦门第一中学2021-2022学年高一上学期12月月考化学试题
福建省厦门第一中学2021-2022学年高一上学期12月月考化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)山西省运城市景胜中学2021-2022学年高一下学期3月月考化学试题
7 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应 |
您最近一年使用:0次
2021-06-29更新
|
9584次组卷
|
21卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)吉林省松原市实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题05 元素及其化合物-备战2022年高考化学真题及地市好题专项集训【山东专用】内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2021-2022学年高三下学期4月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市第十五中学2022-2023学年高三上学期阶段性考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)河北省唐山市第一中学2022-2023学年高三上学期11月期中考试化学试题
8 . 焦亚硫酸钠(Na2S2O5)常用作橡胶凝固剂,湿法制备Na2S2O5的工艺流程如图所示:往Na2CO3饱和溶液中通入SO2至pH=4.1,生成NaHSO3;再加入一定量的Na2CO3固体至pH=7~8,形成Na2SO3悬浊液;继续通入SO2至pH=4.1,生成NaHSO3;结晶脱水获得Na2S2O5。下列说法错误的是
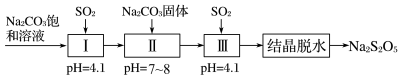
| A.Ⅰ中反应的化学方程式为H2O+Na2CO3+2SO2=2NaHSO3+CO2 |
| B.Ⅱ中反应后的分散系中,分散质粒子的直径大于100nm |
C.Na2S2O5与稀硫酸反应的离子方程式为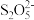 +2H+=2SO2↑+H2O +2H+=2SO2↑+H2O |
| D.可以用硝酸酸化的BaCl2溶液来检验Na2S2O5是否已氧化变质 |
您最近一年使用:0次
名校
9 . 某实验小组探究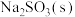 受热分解时的情况。
受热分解时的情况。

下列说法错误的是
A.固体 是混合物,成分为 是混合物,成分为 和 和 |
B.气体 能使品红溶液褪色 能使品红溶液褪色 |
C.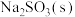 在空气中加热的反应方程式为 在空气中加热的反应方程式为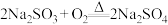 |
D.将 和固体 和固体 混合溶于水,再加足量稀盐酸,有淡黄色沉淀生成 混合溶于水,再加足量稀盐酸,有淡黄色沉淀生成 |
您最近一年使用:0次
解题方法
10 . 如图是硫元素的“价-类”二维图,图中箭头表示物质之间的相互转化。下列有关说法错误的是
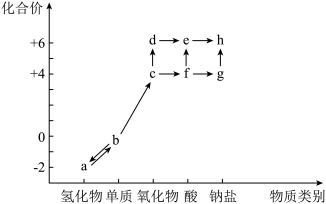

| A.c、f、g分别转化为d、e、h的反应都可以是化合反应 |
| B.a与c可以发生氧化还原反应,且氧化剂与还原剂的物质的量之比为1∶2 |
| C.c与过氧化钠反应得到的产物是g和O2 |
| D.b存在于火山口附近或地壳的岩层中 |
您最近一年使用:0次



