1 . 某小组通过实验探究NO的某些性质。
(1)从氮元素的价态角度分析,NO有_____ 性。
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为______ 。
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O 。
。
ⅱ.Ag+与N2O 反应生成黄色沉淀。
反应生成黄色沉淀。
①检验SO 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,_____ (填操作和实验现象)。
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,_____ (填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是_____ 。
③写出NO与碱性Na2SO3溶液反应的离子方程式______ 。
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
氧化反应:_____ 。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:_____ 。
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是_____ 。
②再向生成的溶液中加入一定量_____ ,以此溶液来吸收NO气体。
(1)从氮元素的价态角度分析,NO有
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O
 。
。ⅱ.Ag+与N2O
 反应生成黄色沉淀。
反应生成黄色沉淀。①检验SO
 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,
上述实验证明NO有氧化性。
实验Ⅱ的目的是
③写出NO与碱性Na2SO3溶液反应的离子方程式
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O

氧化反应:
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是
②再向生成的溶液中加入一定量
您最近一年使用:0次
2022-01-17更新
|
427次组卷
|
3卷引用:北京市石景山区2021-2022学年高三上学期期末考试化学试题
北京市石景山区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题
名校
解题方法
2 . 某同学从物质类别、元素价态的角度,预测 和
和 部分化学性质。
部分化学性质。
(1)从物质类别角度, 属于酸性氧化物,预测
属于酸性氧化物,预测 可以和强碱反应,将少量
可以和强碱反应,将少量 通入NaOH溶液中,反应的离子方程式为
通入NaOH溶液中,反应的离子方程式为___________ 。
(2)从硫元素的价态角度分析, 既有氧化性又有还原性,
既有氧化性又有还原性,___________ 。
①将 通入酸性
通入酸性 溶液中,溶液紫色褪去,生成
溶液中,溶液紫色褪去,生成 。反应结束后,硫元素存在形式应该是
。反应结束后,硫元素存在形式应该是___________ 。
A. B.S C.
B.S C. D.
D.
② 还能和
还能和 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为___________ 。
(3)查阅资料后发现, 的部分化学性质与
的部分化学性质与 类似。该同学向
类似。该同学向 溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是___________ 。但在实验过程中,他并没有检测到该气体生成,可能的原因是___________ 。
 和
和 部分化学性质。
部分化学性质。(1)从物质类别角度,
 属于酸性氧化物,预测
属于酸性氧化物,预测 可以和强碱反应,将少量
可以和强碱反应,将少量 通入NaOH溶液中,反应的离子方程式为
通入NaOH溶液中,反应的离子方程式为(2)从硫元素的价态角度分析,
 既有氧化性又有还原性,
既有氧化性又有还原性,①将
 通入酸性
通入酸性 溶液中,溶液紫色褪去,生成
溶液中,溶液紫色褪去,生成 。反应结束后,硫元素存在形式应该是
。反应结束后,硫元素存在形式应该是A.
 B.S C.
B.S C. D.
D.
②
 还能和
还能和 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为(3)查阅资料后发现,
 的部分化学性质与
的部分化学性质与 类似。该同学向
类似。该同学向 溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
您最近一年使用:0次
3 . 实验室制备SO2并探究其性质的方案如图,回答下列问题:
Ⅰ.制备SO2(部分固定装置略)
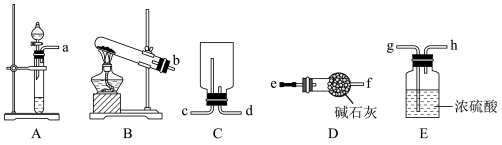
(1)制备SO2可以选择的发生装置为___ (填大写字母),其反应的化学方程式为___ 。
(2)选用图中装置制备并收集一瓶干燥的SO2,其连接顺序为:发生装置→___ (按气流方向,填小写字母)。
Ⅱ.探究SO2与Cu(OH)2悬浊液的反应
查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:ⅰ.配制Cu(OH)2悬浊液:往NaOH溶液中加入CuSO4溶液可得到Cu(OH)2悬浊液。
ⅱ.将SO2通入Cu(OH)2悬浊液中(实验装置如图F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。

(3)配制Cu(OH)2悬浊液时,要保证___ 溶液过量。(填“NaOH”或“CuSO4”)
(4)为确定红色固体成分,进行以下实验:
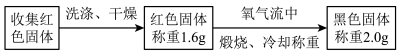
①根据上述实验可得结论:该红色固体为___ 。
②产生红色固体的原因是___ (用离子方程式表示)。
(5)为探究F中溶液呈绿色而不是蓝色的原因,实验如下:
ⅰ.向4mL1mol·L-1的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验ⅰ的目的是___ 。
②溶液显绿色的原因可能是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol·L-1的CuSO4溶液中加入___ (填化学式),得到绿色溶液。
Ⅰ.制备SO2(部分固定装置略)

(1)制备SO2可以选择的发生装置为
(2)选用图中装置制备并收集一瓶干燥的SO2,其连接顺序为:发生装置→
Ⅱ.探究SO2与Cu(OH)2悬浊液的反应
查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:ⅰ.配制Cu(OH)2悬浊液:往NaOH溶液中加入CuSO4溶液可得到Cu(OH)2悬浊液。
ⅱ.将SO2通入Cu(OH)2悬浊液中(实验装置如图F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。

(3)配制Cu(OH)2悬浊液时,要保证
(4)为确定红色固体成分,进行以下实验:

①根据上述实验可得结论:该红色固体为
②产生红色固体的原因是
(5)为探究F中溶液呈绿色而不是蓝色的原因,实验如下:
ⅰ.向4mL1mol·L-1的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验ⅰ的目的是
②溶液显绿色的原因可能是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol·L-1的CuSO4溶液中加入
您最近一年使用:0次
2022-02-19更新
|
585次组卷
|
3卷引用:广东省梅州市2022届高三下学期第一次质检化学试题
广东省梅州市2022届高三下学期第一次质检化学试题(已下线)押广东卷化学第17题 化学实验综合题-备战2022年高考化学临考题号押题(广东卷)湖南省株洲市醴陵市第一中学2021-2022学年高三下学期期中考试化学试题
解题方法
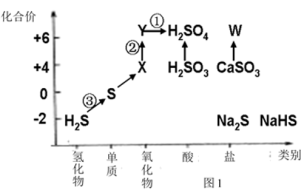
4 . 依据图中硫元素及其化合物的转化关系,回答问题:___________ 。
(2)图中,X的化学式为___________ ,从化合价上看,X具有___________ (填数字)
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有___________ (填数字)。
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为___________ mol。也可表示为2H2S+SO2=3S↓+2H2O,当生成1molS时,转移的电子为___________ mol。
(5)SO2可使酸性高锰酸钾溶液褪色,体现了___________ (填数字)
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:___________ 。
(2)图中,X的化学式为
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为
(5)SO2可使酸性高锰酸钾溶液褪色,体现了
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:
您最近一年使用:0次
2021-07-05更新
|
435次组卷
|
3卷引用:湖北省鄂州市2020-2021学年高一下学期期末质量监测化学试题
湖北省鄂州市2020-2021学年高一下学期期末质量监测化学试题(已下线)4.2.1 含硫物质间的转化-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)广东省揭阳市惠来同仁北实高级中学2023-2024学年高一下学期3月月考化学试题
解题方法
5 . 硫氧粉( )广泛应用于化工生产中,可用碳酸钠和二氧化硫反应制取。为探究某硫氧粉样品的成分,某化学兴趣小组的同学设计了如下实验。
)广泛应用于化工生产中,可用碳酸钠和二氧化硫反应制取。为探究某硫氧粉样品的成分,某化学兴趣小组的同学设计了如下实验。
【查阅资料】
① 易溶于水,能与称盐酸或稀硫酸发生反应生成
易溶于水,能与称盐酸或稀硫酸发生反应生成 ,能与氯化钡溶液反应生成白色沉淀。
,能与氯化钡溶液反应生成白色沉淀。
② 能使品红溶液褪色,常用品红溶液检验
能使品红溶液褪色,常用品红溶液检验 ;能使澄清的石灰水变浑浊。
;能使澄清的石灰水变浑浊。
③ 不能使品红溶液褪色,不能与酸性高锰酸钾溶液反应。
不能使品红溶液褪色,不能与酸性高锰酸钾溶液反应。
【探究一】硫氧粉样品的成分
【提出猜想】猜想1: 猜想2:
猜想2: 、
、
【实验探究】
(1)取少量硫氧粉样品,进行如下实验,选择所需装置对气体X的成分进行探究。___________ (填字母序号)。B装置的作用是___________ ;若出现___________ 现象,证明气体X的成分为 ,说明猜想1正确。
,说明猜想1正确。
【探究二】该硫氧粉样品久置后的成分
【提出猜想】
(2)猜想1: 猜想2:
猜想2:___________ 猜想3:
【实验探究】
(3)取少量久置的硫氧粉样品加水溶解,请设计实验方案验证猜想2成立:___________ 。
【反思交流】
(4)久置硫氧粉变质的原因___________ (用化学方程式表示)。
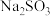 )广泛应用于化工生产中,可用碳酸钠和二氧化硫反应制取。为探究某硫氧粉样品的成分,某化学兴趣小组的同学设计了如下实验。
)广泛应用于化工生产中,可用碳酸钠和二氧化硫反应制取。为探究某硫氧粉样品的成分,某化学兴趣小组的同学设计了如下实验。【查阅资料】
①
 易溶于水,能与称盐酸或稀硫酸发生反应生成
易溶于水,能与称盐酸或稀硫酸发生反应生成 ,能与氯化钡溶液反应生成白色沉淀。
,能与氯化钡溶液反应生成白色沉淀。②
 能使品红溶液褪色,常用品红溶液检验
能使品红溶液褪色,常用品红溶液检验 ;能使澄清的石灰水变浑浊。
;能使澄清的石灰水变浑浊。③
 不能使品红溶液褪色,不能与酸性高锰酸钾溶液反应。
不能使品红溶液褪色,不能与酸性高锰酸钾溶液反应。【探究一】硫氧粉样品的成分
【提出猜想】猜想1:
 猜想2:
猜想2: 、
、
【实验探究】
(1)取少量硫氧粉样品,进行如下实验,选择所需装置对气体X的成分进行探究。
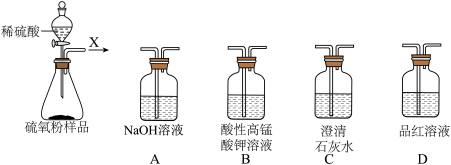
 ,说明猜想1正确。
,说明猜想1正确。【探究二】该硫氧粉样品久置后的成分
【提出猜想】
(2)猜想1:
 猜想2:
猜想2:
【实验探究】
(3)取少量久置的硫氧粉样品加水溶解,请设计实验方案验证猜想2成立:
【反思交流】
(4)久置硫氧粉变质的原因
您最近一年使用:0次
解题方法
6 . 下列实验操作、现象和结论均正确的是
操作 | 现象 | 结论 | |
A | 将过量 溶液滴入酸性 溶液滴入酸性 溶液中 溶液中 | 溶液褪色 |  溶液具有还原性 溶液具有还原性 |
B | 常温下,在铜片上滴几滴浓硫酸 | 产生气泡,溶液变蓝色 | 常温下,铜和浓硫酸反应 |
C | 将同样大小的锌片分别加入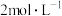 稀硫酸和 稀硫酸和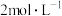 稀盐酸中,加热至相同温度 稀盐酸中,加热至相同温度 | 前者反应较快 | 升高温度加快反应速率 |
D | 将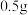 淀粉和 淀粉和 稀硫酸共热后,加入氢氧化钠溶液调至碱性,再加入少量碘水 稀硫酸共热后,加入氢氧化钠溶液调至碱性,再加入少量碘水 | 溶液变蓝色 | 淀粉未水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-22更新
|
64次组卷
|
2卷引用:内蒙古自治区兴安盟2023-2024学年高二下学期学业水平质量检测化学试题
解题方法
7 . 下列方案设计、现象和结论有不正确的是
| 方案设计 | 现象 | 结论 | |
| A | 取两份新制氯水,分别滴加 溶液和淀粉 溶液和淀粉 溶液 溶液 | 前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| B | 将 溶液和稀 溶液和稀 混合 混合 | 得到沉淀,且生成的气体可使品红溶液褪色 |  既体现还原性又体现氧化性 既体现还原性又体现氧化性 |
| C | 将少量的 粉加入稀 粉加入稀 中,充分反应后,滴入 中,充分反应后,滴入 溶液 溶液 | 溶液呈血红色 | 稀 将 将 氧化为 氧化为 |
| D | 向氯化钡溶液中滴加 溶液,再滴加双氧水 溶液,再滴加双氧水 | 滴加 溶液无现象,滴加双氧水后产生白色沉淀 溶液无现象,滴加双氧水后产生白色沉淀 | 说明 价硫具有还原性 价硫具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 .  是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有广泛的应用。
是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有广泛的应用。
(1)某兴趣小组为探究 溶液的性质,配制了100 mL 0.1 mol⋅L
溶液的性质,配制了100 mL 0.1 mol⋅L
 溶液。
溶液。
①在实验室中配制溶液需要用到的玻璃仪器有玻璃棒、烧杯、量筒、_______ 。
②同学依据S元素的化合价推测 具有氧化性,将0.1 mol⋅L
具有氧化性,将0.1 mol⋅L
 溶液和
溶液和 溶液混合,滴加适量稀硫酸,有乳白色浑浊出现,该反应的离子方程式为
溶液混合,滴加适量稀硫酸,有乳白色浑浊出现,该反应的离子方程式为_______ 。
(2)工业上利用 将废水中的Cr(Ⅵ)转化为Cr(Ⅲ)(
将废水中的Cr(Ⅵ)转化为Cr(Ⅲ)(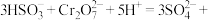
 ),然后加入石灰乳转化为
),然后加入石灰乳转化为 沉淀。转化过程中测得相同时间内废水中残留的Cr(Ⅵ)浓度与废水pH的关系如图所示。
沉淀。转化过程中测得相同时间内废水中残留的Cr(Ⅵ)浓度与废水pH的关系如图所示。 具有
具有_____ (填“氧化性”或“还原性”)。
②废水的pH比较小时,不利于Cr(Ⅵ)转化为Cr(Ⅲ),是由于溶液中 发生了副反应,该副反应的离子方程式为
发生了副反应,该副反应的离子方程式为______ ;废水的pH大于2.5时,残留Cr(Ⅵ)的浓度升高,其原因可能是______ 。
(3)亚硫酸氢钠纯度的测定。
Ⅰ.在250 mL碘量瓶中加入30.00 mL 0.1000 mol⋅L
 溶液和5 mL稀盐酸。
溶液和5 mL稀盐酸。
Ⅱ.称取0.2500 g 样品,快速加入250 mL碘量瓶中,立即盖上瓶塞,在暗处放置5 min。
样品,快速加入250 mL碘量瓶中,立即盖上瓶塞,在暗处放置5 min。
Ⅲ.向碘量瓶中逐滴加入0.1000 mol⋅L
 溶液至20.00 mL恰好反应。
溶液至20.00 mL恰好反应。
已知步骤Ⅲ发生的反应为 。
。
①步骤Ⅱ中发生反应的离子方程式为______ 。
②该亚硫酸氢钠样品的纯度为_______ 。
 是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有广泛的应用。
是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有广泛的应用。(1)某兴趣小组为探究
 溶液的性质,配制了100 mL 0.1 mol⋅L
溶液的性质,配制了100 mL 0.1 mol⋅L
 溶液。
溶液。①在实验室中配制溶液需要用到的玻璃仪器有玻璃棒、烧杯、量筒、
②同学依据S元素的化合价推测
 具有氧化性,将0.1 mol⋅L
具有氧化性,将0.1 mol⋅L
 溶液和
溶液和 溶液混合,滴加适量稀硫酸,有乳白色浑浊出现,该反应的离子方程式为
溶液混合,滴加适量稀硫酸,有乳白色浑浊出现,该反应的离子方程式为(2)工业上利用
 将废水中的Cr(Ⅵ)转化为Cr(Ⅲ)(
将废水中的Cr(Ⅵ)转化为Cr(Ⅲ)(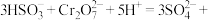
 ),然后加入石灰乳转化为
),然后加入石灰乳转化为 沉淀。转化过程中测得相同时间内废水中残留的Cr(Ⅵ)浓度与废水pH的关系如图所示。
沉淀。转化过程中测得相同时间内废水中残留的Cr(Ⅵ)浓度与废水pH的关系如图所示。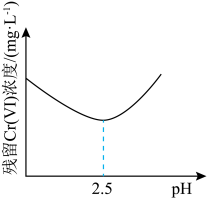
 具有
具有②废水的pH比较小时,不利于Cr(Ⅵ)转化为Cr(Ⅲ),是由于溶液中
 发生了副反应,该副反应的离子方程式为
发生了副反应,该副反应的离子方程式为(3)亚硫酸氢钠纯度的测定。
Ⅰ.在250 mL碘量瓶中加入30.00 mL 0.1000 mol⋅L

 溶液和5 mL稀盐酸。
溶液和5 mL稀盐酸。Ⅱ.称取0.2500 g
 样品,快速加入250 mL碘量瓶中,立即盖上瓶塞,在暗处放置5 min。
样品,快速加入250 mL碘量瓶中,立即盖上瓶塞,在暗处放置5 min。Ⅲ.向碘量瓶中逐滴加入0.1000 mol⋅L

 溶液至20.00 mL恰好反应。
溶液至20.00 mL恰好反应。已知步骤Ⅲ发生的反应为
 。
。①步骤Ⅱ中发生反应的离子方程式为
②该亚硫酸氢钠样品的纯度为
您最近一年使用:0次
名校
9 . 学科思想方法是学好化学的关键,下列有关学科思想方法的理解正确 的是
| A.根据元素的性质分析,氮元素非金属较强,所以N2的化学性质较活泼 |
| B.SO2和氯水都具有漂白性,当SO2与Cl2体积比1:1通入水中所得溶液漂白性增强 |
| C.通过类比方法可知铝与稀硫酸反应生成氢气,则铝与稀硝酸反应生成氢气 |
| D.从硫的化合价角度分析,Na2SO3既有氧化性又有还原性 |
您最近一年使用:0次
10 . 亚硫酸的性质
(1)弱酸性:___________ (电离方程式)。
(2)不稳定性:___________ 。
(3)强还原性(与O2、H2O2反应):___________ 。
(4)弱氧化性(与H2S反应):___________ 。
(1)弱酸性:
(2)不稳定性:
(3)强还原性(与O2、H2O2反应):
(4)弱氧化性(与H2S反应):
您最近一年使用:0次



