解题方法
1 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用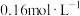
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有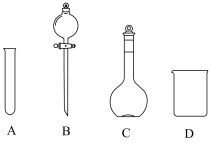
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用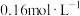
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
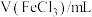 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
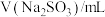 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近半年使用:0次
解题方法
2 . “价-类二维图”是元素化合物知识学习的重要模型,下图是某短周期主族元素的“价-类二维图”,其最高化合价c与最低化合价a的代数和为4。
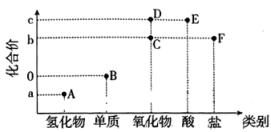
A.实验室可用 溶液吸收气体A 溶液吸收气体A |
| B.C分子的VSEPR模型为V形 |
| C.可用溴水检验F是否变质 |
| D.工业上通过B→D→E两步转化制备E |
您最近半年使用:0次
3 . “科学探究与创新意识”是化学学科核心素养之一、某研究小组用下图装置进行探究实验。下列说法正确的是
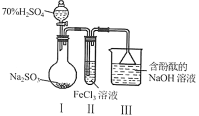
A.Ⅰ中70% 在反应中作氧化剂 在反应中作氧化剂 |
B.取少量反应后Ⅱ中溶液加入 溶液有蓝色沉淀生成 溶液有蓝色沉淀生成 |
C.Ⅱ中发生反应的离子方程式为: |
D.Ⅲ中溶液褪色,说明 具有漂白性 具有漂白性 |
您最近半年使用:0次
解题方法
4 . 研究发现,利用烟气脱硫脱硝一体化技术,脱硫的同时也可以脱硝。_____

您最近半年使用:0次
5 . 光催化剂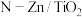 可用于含硫废液的氧化处理,光生电子
可用于含硫废液的氧化处理,光生电子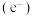 与水电离出的
与水电离出的 、
、 作用生成过氧羟基自由基
作用生成过氧羟基自由基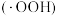 ,空穴
,空穴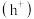 与水电离出的
与水电离出的 作用生成羟基自由基
作用生成羟基自由基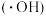 ,
, 分别与
分别与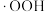 和
和 反应生成
反应生成 ,变化过程如图所示。下列说法错误的是
,变化过程如图所示。下列说法错误的是
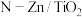 可用于含硫废液的氧化处理,光生电子
可用于含硫废液的氧化处理,光生电子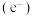 与水电离出的
与水电离出的 、
、 作用生成过氧羟基自由基
作用生成过氧羟基自由基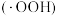 ,空穴
,空穴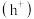 与水电离出的
与水电离出的 作用生成羟基自由基
作用生成羟基自由基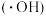 ,
, 分别与
分别与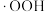 和
和 反应生成
反应生成 ,变化过程如图所示。下列说法错误的是
,变化过程如图所示。下列说法错误的是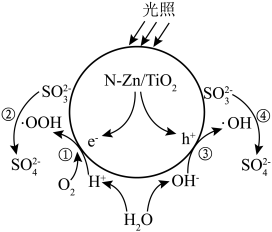
A.通过①②过程和③④过程产生的 之比为 之比为 |
B. 氧化 氧化 的反应为 的反应为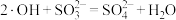 |
C. 过低或过高均会影响催化剂的催化效果 过低或过高均会影响催化剂的催化效果 |
D.氧化含硫废液的总反应为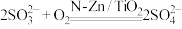 |
您最近半年使用:0次
2024-04-16更新
|
212次组卷
|
2卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
名校
解题方法
6 . 为了增强大气污染防治的科学性、针对性和有效性,研究大气颗粒物的化学组成和分布特征具有很重要的意义。水溶性离子是PM2.5的重要组成部分,主要包含 、
、 、
、 、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、
、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、 、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:
、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:
(1)常温下,将某地大气污染物样品配制成溶液,所得溶液显______。
(2)PM2.5中的 主要源自燃煤产生的
主要源自燃煤产生的 ,写出SO2转化为H2SO4的化学方程式
,写出SO2转化为H2SO4的化学方程式______ 、______ 。
 、
、 、
、 、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、
、Cl-、Na+、Ca2+、Mg2+等,这些离子多由化石燃料燃烧、机动车尾气等排放的SO2、 、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:
、NH3等气体经过复杂的大气物理化学过程二次转化而来。完成下列问题:(1)常温下,将某地大气污染物样品配制成溶液,所得溶液显______。
| A.酸性 | B.碱性 | C.中性 | D.无法判断 |
 主要源自燃煤产生的
主要源自燃煤产生的 ,写出SO2转化为H2SO4的化学方程式
,写出SO2转化为H2SO4的化学方程式
您最近半年使用:0次
7 . Fe3S4固体是一种重要的磁性材料,以它为原料实现如下化合物的转化: 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。
请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为___________ ,无色酸性溶液F中的含硫阴离子有___________ 。
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4)写出F→G反应的化学方程式___________ 。请设计实验方案确定溶液G中的阴离子___________ 。

 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式
(3)下列说法正确的是___________。
| A.固体A中可能含有FeO | B.无色气体E能完全溶于水 |
| C.溶液C呈酸性,是由于Fe3+水解 | D.溶液B可溶解铜 |
(4)写出F→G反应的化学方程式
您最近半年使用:0次
名校
8 . 某实验小组探究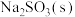 受热分解时的情况。
受热分解时的情况。

下列说法错误的是
A.固体 是混合物,成分为 是混合物,成分为 和 和 |
B.气体 能使品红溶液褪色 能使品红溶液褪色 |
C.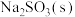 在空气中加热的反应方程式为 在空气中加热的反应方程式为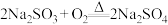 |
D.将 和固体 和固体 混合溶于水,再加足量稀盐酸,有淡黄色沉淀生成 混合溶于水,再加足量稀盐酸,有淡黄色沉淀生成 |
您最近半年使用:0次
9 . 实验室制备SO2并探究SO2的性质,利用如图装置进行实验。

回答下列问题:
(1)盛装浓硫酸的仪器名称为________ ,装置A中的化学方程式为________ 。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为________ 。
(3)若试剂a为BaCl2溶液,则B中________ (填“能”或“不能”)观察到有白色沉淀生成,请说明原因: _______ 。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:________ ;
②推测含Ag2SO4的原因是_______ 。

回答下列问题:
(1)盛装浓硫酸的仪器名称为
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为
(3)若试剂a为BaCl2溶液,则B中
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:
②推测含Ag2SO4的原因是
您最近半年使用:0次
名校
10 . 书写下列反应的离子 方程式:
(1)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2.上述制备I2的总反应___________ 。
(2)在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+
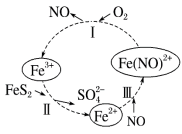
①反应I:___________ 。
②反应II:___________ 。
(3)红磷充分燃烧的产物与足量热的NaOH溶液反应,该反应的离子方程式是___________ 。
(4)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈褐色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是___________ 。
(5)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:
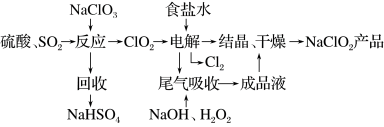
①写出“反应”步骤中生成ClO2的化学方程式:___________ 。
② “电解”过程阴极主反应的方程式:___________ 。
③“尾气吸收”是吸收“电解”过程排出的少量ClO2,写出此吸收反应的离子方程式:___________ 。
(1)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2.上述制备I2的总反应
(2)在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
①反应I:
②反应II:
(3)红磷充分燃烧的产物与足量热的NaOH溶液反应,该反应的离子方程式是
(4)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈褐色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(5)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:

①写出“反应”步骤中生成ClO2的化学方程式:
② “电解”过程阴极主反应的方程式:
③“尾气吸收”是吸收“电解”过程排出的少量ClO2,写出此吸收反应的离子方程式:
您最近半年使用:0次



