名校
解题方法
1 . 已知: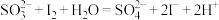 。某溶液中可能含有
。某溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 ,且所有离子的物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
,且所有离子的物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
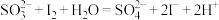 。某溶液中可能含有
。某溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 ,且所有离子的物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
,且所有离子的物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是A.肯定不含 | B.肯定含有 |
C.肯定含有 | D.肯定含有 |
您最近一年使用:0次
2023-03-05更新
|
658次组卷
|
11卷引用:人教版(2019)高一必修第一册 模块综合测评-B卷
人教版(2019)高一必修第一册 模块综合测评-B卷(已下线)热点02 氮及其化合物黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一4月月考化学试题辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题山西省太原市第五中学校2022-2023学年高一下学期3月月考试题化学试题四川省射洪中学校2022-2023学年高一下学期期中考试化学试题四川省华蓥中学2022-2023学年高一下学期5月月考化学试题河北省石家庄市2023-2024学年高一上学期期末教学质量检测化学试题江西宜春市铜鼓中学2022-2023学年高一下学期第一次段考化学试题安徽省当涂第一中学2022-2023学年高一下学期4月期中化学试题
2 . 某溶液中可能含有K+、Na+、Mg2+、 、Fe2+、Br-、
、Fe2+、Br-、 、
、 、
、 中的若干种离子。某同学做了如下实验:①取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色②另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成③蘸取原溶液,做焰色试验,透过蓝色钴玻璃观察到火焰呈紫色。为进一步确定该溶液的组成,无需进行的实验是
中的若干种离子。某同学做了如下实验:①取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色②另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成③蘸取原溶液,做焰色试验,透过蓝色钴玻璃观察到火焰呈紫色。为进一步确定该溶液的组成,无需进行的实验是
 、Fe2+、Br-、
、Fe2+、Br-、 、
、 、
、 中的若干种离子。某同学做了如下实验:①取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色②另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成③蘸取原溶液,做焰色试验,透过蓝色钴玻璃观察到火焰呈紫色。为进一步确定该溶液的组成,无需进行的实验是
中的若干种离子。某同学做了如下实验:①取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色②另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成③蘸取原溶液,做焰色试验,透过蓝色钴玻璃观察到火焰呈紫色。为进一步确定该溶液的组成,无需进行的实验是| A.取少量溶液,滴加氯水和CCl4,振荡、静置 |
| B.上述实验③不透过蓝色钴玻璃观察火焰颜色 |
| C.取少量溶液,滴加适量的稀硫酸和品红溶液 |
| D.取少量溶液,滴加适量浓NaOH溶液,加热,用湿润的红色石蕊试纸检验气体 |
您最近一年使用:0次
2023-01-31更新
|
550次组卷
|
13卷引用:2018年高考题及模拟题汇编 专题03 离子反应
(已下线)2018年高考题及模拟题汇编 专题03 离子反应(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 讲夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氮及其化合物(提升练习)【全国百强校】河北省邢台市第一中学2017-2018学年高二下学期第三次月考化学试题河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题黑龙江省哈尔滨市第三中学校2021届高三上学期第二次验收考试化学试题(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)浙江省宁波市2018年3月新高考选考适应性考试化学试题【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题浙江省“七彩阳光”新高考研究联盟2018-2019学年高一下学期期中考试化学试题浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(1)辽宁省兴城市高级中学2021-2022学年高三上学期10月月考化学试题黑龙江省齐齐哈尔三立高中2022-2023学年高一下学期期初考试化学试题
19-20高三上·陕西西安·期中
名校
解题方法
3 . 下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | 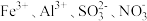 | 过量的盐酸 |  |
| B | 透明溶液中: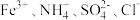 | 过量的铜粉 | 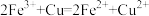 |
| C |  | 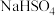 溶液 溶液 | 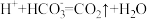 |
| D |  的溶液中: 的溶液中: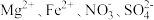 | 双氧水 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-10更新
|
192次组卷
|
14卷引用:小题必刷04 离子共存——2021年高考化学一轮复习小题必刷(通用版)
(已下线)小题必刷04 离子共存——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷06 与量有关的离子方程式书写——2021年高考化学一轮复习小题必刷(通用版)陕西省西安市长安区第五中学2019届高三上学期期中考试化学试题河北省衡水市衡水中学2019届高三上学期期中考试化学试题四川省宜宾市叙州区第二中学2020届高三下学期第二次高考适应性考试理综化学试题山西省运城市永济涑北中学2020-2021学年高三上学期10月月考化学试题(已下线)第05讲 离子共存 离子的检验和推断(精练)-2022年高考化学一轮复习讲练测宁夏石嘴山市第三中学2020届高三上学期期中考试化学试题福建省三明第一中学2020届高三上学期第二次月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二下学期期末考试化学试题山西省太原市第五中学2021-2022学年高三上学期11月化学月考试题四川省内江市第六中学2022-2023学年高三上学期入学考试化学试题 广东省梅州市兴宁市齐昌中学2022-2023学年高三上学期第二次质检考试化学试题陕西省渭南市2023-2024学年高三上学期期中检测化学试题
11-12高三上·浙江绍兴·期中
名校
4 . 下列过程中,最终的白色沉淀物不一定是BaSO4的是
A.Fe(NO3)2溶液 白色沉淀 白色沉淀 |
B.Ba(NO3)2溶液 白色沉淀 白色沉淀 |
C.无色溶液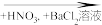 白色沉淀 白色沉淀 |
D.无色溶液 无色溶液 无色溶液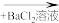 白色沉淀 白色沉淀 |
您最近一年使用:0次
2022-02-18更新
|
1095次组卷
|
30卷引用:2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】
(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】(已下线)2019年8月25日 《每日一题》2020年高考一轮复习—— 每周一测(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》2020届高三化学一轮复习 化学基础实验(选择题和大题训练)(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测2019年广东省清远市高三上学期期末调研考试化学试题上海市南洋模范中学2020—2021学年高二上学期开学考试化学(等级考)试题陕西省西北工业大学附属中学2018-2019学年高一上学期期末考试化学试题(已下线)第13讲 硫及其化合物(精讲)-2022年一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第13讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第11讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第2讲 离子反应和离子方程式(已下线)第4讲 浓硫酸 不同价态含硫物质的转化(已下线)2012届浙江省绍兴一中高三上学期期中考试化学试卷(已下线)2012届江西省吉安一中高三上学期期中考试化学试卷甘肃省武威第一中学2018-2019学年高一下学期第一次阶段测试化学试题山东省临沂市临沂第二十四中学2020-2021学年高一下学期期中考试化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(二)化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题(已下线)专题03 硫酸和硝酸专讲(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)云南省玉溪市一中2020-2021学年高一下学期第一次月考化学试题新疆哈密市第八中学2021-2022学年高一下学期期末考试化学试题贵州省松桃民族中学2022-2023学年高一下学期3月月考化学试题云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一下学期4月月考化学试题
5 . 为确定下列久置于空气中的物质是否变质,所选检验试剂(括号内物质)能达到目的的是
| A.NaOH溶液[Ba(OH)2溶液] | B.漂粉精(Na2CO3溶液) |
| C.氯水(AgNO3溶液) | D.Na2SO3溶液(BaCl2溶液) |
您最近一年使用:0次
2021-04-10更新
|
432次组卷
|
8卷引用:第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价
(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价(已下线)山东省济宁市2019-2020学年高一下学期教学质量检测化学试题山东省济宁市2018-2019学年高一下学期期末考试化学试题上海市松江区2021届高三二模化学试题天津市南开区2021-2022学年高三上学期期中考试化学试题湖北省武汉市第三中学2022-2023学年高一上学期12月月考化学试题安徽省阜阳市第三中学2023-2024学年高一上学期1月期末化学试题安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题
6 . 某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(ts)后,溶液突然变蓝。
查阅资料知:IO 在酸性溶液中氧化I-,发生的反应为IO
在酸性溶液中氧化I-,发生的反应为IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
(1)针对ts前溶液未变蓝,小组做出如下假设:
i.ts前未生成I2,是由于反应的活化能__ (填“大”或“小”),反应速率慢导致的。
ii.ts前生成了I2,但由于存在Na2SO3,Na2SO3将生成的I2还原。
(2)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入__ ,蓝色迅速消失,后再次变蓝。
(3)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如图。
实验III:K闭合后,电流表的指针偏转情况记录如表:
①K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,生成白色沉淀。
②0~t1s时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断a极的电极反应式为__ 。
③结合反应解释t2~t3s时指针回到“0”处的原因___ 。
(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是__ (填字母代号)。
A.对比实验Ⅰ、Ⅱ,ts后溶液变蓝,I中SO 被完全氧化
被完全氧化
B.对比实验Ⅰ、Ⅲ,ts前IO 未发生反应
未发生反应
C.实验Ⅲ中指针返回X处的原因,可能是I2氧化SO
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(ts)后,溶液突然变蓝。
查阅资料知:IO
 在酸性溶液中氧化I-,发生的反应为IO
在酸性溶液中氧化I-,发生的反应为IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。(1)针对ts前溶液未变蓝,小组做出如下假设:
i.ts前未生成I2,是由于反应的活化能
ii.ts前生成了I2,但由于存在Na2SO3,Na2SO3将生成的I2还原。
(2)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入
(3)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如图。
实验III:K闭合后,电流表的指针偏转情况记录如表:
| 表盘 | 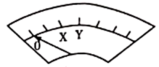 | 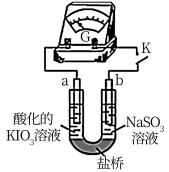 | ||
| 时间/s | 0~t1 | t2~t3 | t4 | |
| 偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
②0~t1s时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断a极的电极反应式为
③结合反应解释t2~t3s时指针回到“0”处的原因
(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是
A.对比实验Ⅰ、Ⅱ,ts后溶液变蓝,I中SO
 被完全氧化
被完全氧化B.对比实验Ⅰ、Ⅲ,ts前IO
 未发生反应
未发生反应C.实验Ⅲ中指针返回X处的原因,可能是I2氧化SO

您最近一年使用:0次
7 . 在印染工业中,连二亚硫酸钠(Na2S2O4)因能使染好的布褪色,而使布能重新染色,故而俗称保险粉。其可溶于水,不溶于甲醇。工业制备流程如图。下列说法不正确的是
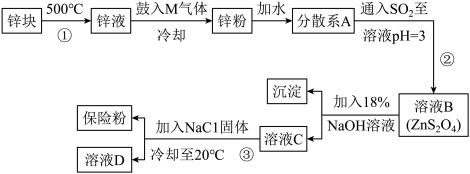

A.将等体积0.04mol•L-1AgNO3溶液和0.02mol•L-1碱性Na2S2O4溶液混合,恰好完全反应,反应后溶液中有纳米级的银粉生成,反应的离子方程式2Ag+ +S2O +4OH-=2Ag+2SO +4OH-=2Ag+2SO +2H2O +2H2O |
| B.由锌块制备锌粉目的是增大锌反应的表面积,加快化学反应速率 |
| C.流程③过滤前加入NaCl固体的作用之一是使Na+浓度增大,便于Na2S2O4结晶析出 |
| D.流程①步骤可在耐高温的Al2O3坩埚中进行 |
您最近一年使用:0次
2021-02-20更新
|
288次组卷
|
4卷引用:浙江省杭州第二中学2021届高三上学期期中考试化学试题
浙江省杭州第二中学2021届高三上学期期中考试化学试题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
20-21高二上·湖北荆门·阶段练习
名校
8 . 已知碳酸、亚硫酸、次氯酸的电离平衡常数如表,下列说法正确的是
| 物质 | H2CO3 | H2SO3 | HClO | |
| 电离平 衡常数 | Ka1 | 4.40×10-7 | 1.54×10-2 | 2.59×10-8 |
| Ka2 | 5.61×10-11 | 1.02×10-7 | ||
| A.相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
B.Na2CO3溶液中通入少量SO2,发生反应:2CO +SO2+H2O=2HCO +SO2+H2O=2HCO +SO +SO |
C.NaHCO3溶液中通入少量SO2,发生反应:2HCO +SO2=2CO2+SO +SO2=2CO2+SO |
| D.向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
您最近一年使用:0次
20-21高三上·浙江·阶段练习
9 . 某固体混合物X,含有Na2CO3、Na2SO3、Fe、Fe2O3、NaHSO4、BaCl2中的几种,进行如下实验:
①X与足量蒸馏水反应,得到沉淀A、溶液A和a mL气体A,气体A通入酸性高锰酸钾溶液中得到b mL气体B,a>b(气体体积均在常温常压下测定);
②溶液A与NaOH溶液反应,得到白色沉淀B,很快颜色变深。
下列说法正确的是
| A.气体B一定是CO2 |
| B.固体A可能含BaCO3 |
| C.该固体混合物一定含Fe和Na2SO3、NaHSO4、BaCl2 |
| D.白色沉淀B可能是混合物 |
您最近一年使用:0次
解题方法
10 . 资料显示: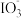 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
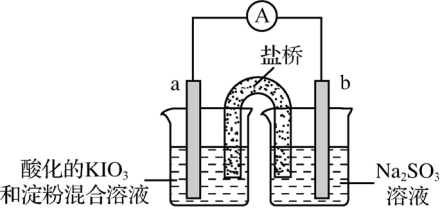
①甲同学在b电极附近的溶液中检测出了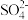
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
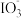 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
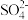
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次



