解题方法
1 . 资料显示: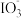 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
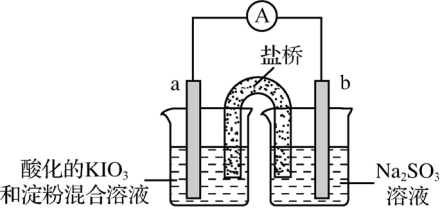
①甲同学在b电极附近的溶液中检测出了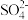
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
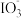 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
2 . 根据下列实验操作和现象所得到的结论错误的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向2mL0.1FeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液,黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-03更新
|
274次组卷
|
3卷引用:第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练
(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练黑龙江省哈尔滨市第三中学2019-2020学年高二下学期6月阶段性测试化学试题A山东省临沂市莒南第二中学2021届高三10月月考化学试题
解题方法
3 . 易混易错题组:离子方程式的书写
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为______________ 。
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式__________________ 。
(学法题)书写此类离子方程式的关键是,抓住______________ 量物质。
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为___________________ 。
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:____________ 。
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的__________ 顺序。
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为_________________ 。
②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为___________________________ 。
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是_______________ 。
④对比②和③实验所得的结果,将I2、ClO-、 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为___________ 。
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式
(学法题)书写此类离子方程式的关键是,抓住
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将
 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是
④对比②和③实验所得的结果,将I2、ClO-、
 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为
您最近一年使用:0次
名校
解题方法
4 . 从宏观现象探究微观本质是重要的化学学科素养。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
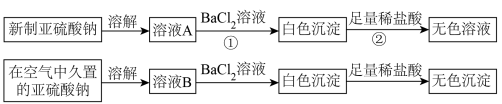
(1)写出上述实验中②的离子方程式:_________ 。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有________ (填化学式)。
(3)亚硫酸钠晶体样品若变质,下列说法错误的是___________ 。
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
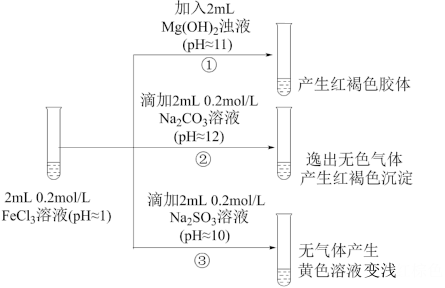
(1)①中反应的离子方程式是___________ 。
(2)②中逸出的无色气体是_____________ (写化学式)。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_________ 。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是______________ 。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:

(1)写出上述实验中②的离子方程式:
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有
(3)亚硫酸钠晶体样品若变质,下列说法错误的是
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

(1)①中反应的离子方程式是
(2)②中逸出的无色气体是
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
您最近一年使用:0次
5 . 为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________ 、________ 。
(2)写出Na2SO3固体氧化变质的化学方程式_____________ 。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________ ,
在过滤前,需要检验是否沉淀完全,其操作是______________ 。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________ (填“偏高”或“偏低”)。
(5)若操作正确,则m1________ m2(填“>”、“<”或“=”),原因是_______________ 。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________ (注明表达式中所用的有关符号的含义和单位)。
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、
(2)写出Na2SO3固体氧化变质的化学方程式
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是
在过滤前,需要检验是否沉淀完全,其操作是
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果
(5)若操作正确,则m1
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为
您最近一年使用:0次
2017-06-26更新
|
262次组卷
|
3卷引用:苏教版2017届高三单元精练检测一化学试题



