1 . 如图是氮元素的几种价态与物质类别的对应关系。
1.写出 的一种用途:
的一种用途:___________ 。
2. 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为___________ 。
3.实验室制取物质B的化学方程式为___________ 。
4.将 铜与
铜与 一定浓度的硝酸发生反应,铜完全溶解,产生
一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为
和NO混合气体的体积为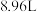 (标况)。待产生的气体全部释放后,向溶液加入
(标况)。待产生的气体全部释放后,向溶液加入
 的
的 溶液,恰好使溶液中的
溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________  。(写出计算过程)
。(写出计算过程)

1.写出
 的一种用途:
的一种用途:2.
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为3.实验室制取物质B的化学方程式为
4.将
 铜与
铜与 一定浓度的硝酸发生反应,铜完全溶解,产生
一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为
和NO混合气体的体积为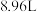 (标况)。待产生的气体全部释放后,向溶液加入
(标况)。待产生的气体全部释放后,向溶液加入
 的
的 溶液,恰好使溶液中的
溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次
2 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
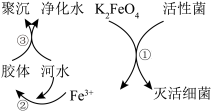
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
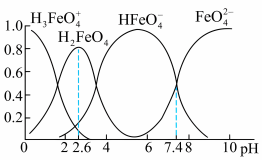
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
3 . 自然界中的氮元素以氮气、氮氧化物和硝酸盐等形式存在,人类对氮元素的利用,就是实现氮元素在不同物质之间的转化。
(1)氮是植物生长的必需元素。有关说法中错误的是______
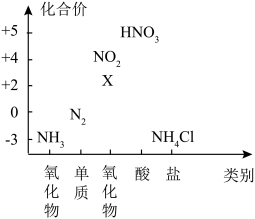
(2)如图为氮元素的价类二维图。下列说法正确的是______
(3)下列有关物质的性质与用途具有对应关系的是______
(4)氨气是生产氮肥的主要原料,工业合成氨的化学方程式为___________ 。结合化学方程式简述为何氮肥常用铵态氮肥而不直接是用氨水___________ 。
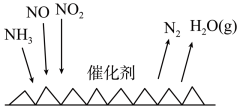
(5) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当 与
与 的物质的量之比为
的物质的量之比为 时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为___________ 。
(6)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ (填“浓”或“稀”)硝酸,原因是___________ 。
(1)氮是植物生长的必需元素。有关说法中错误的是______
| A.氮气分子很稳定 | B.尿素属于铵态氮肥 |
| C.工业合成氨是人工固氮 | D.闪电实现了大气固氮 |
(2)如图为氮元素的价类二维图。下列说法正确的是______

| A.X属于酸性氧化物 |
B. 转化为 转化为 一定需要加入氧化剂 一定需要加入氧化剂 |
C.一定条件下, 和 和 反应可以转化成 反应可以转化成 |
D.实验室采用加热分解 固体制取 固体制取 |
(3)下列有关物质的性质与用途具有对应关系的是______
A. 易溶于水,可用作制冷剂 易溶于水,可用作制冷剂 | B. 具有强氧化性,可用于制 具有强氧化性,可用于制 |
C. 受热易分解,可用作化肥 受热易分解,可用作化肥 | D. 性质稳定,可用于食品保护 性质稳定,可用于食品保护 |
(4)氨气是生产氮肥的主要原料,工业合成氨的化学方程式为
(5)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当 与
与 的物质的量之比为
的物质的量之比为 时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
(6)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
您最近一年使用:0次
名校
4 . 下列有关物质的性质与用途不具有对应关系的是
| A.SO2具有还原性,可用作葡萄酒抗氧化剂 |
| B.SO2具有氧化性,可用作纸浆漂白剂 |
| C.SO2是酸性氧化物,可用氢氧化钠溶液吸收 |
| D.浓硫酸有吸水性,可作气体干燥剂 |
您最近一年使用:0次
2023-12-21更新
|
273次组卷
|
4卷引用:上海市吴淞中学2023-2024学年高一上学期期末质量检测 化学试题
上海市吴淞中学2023-2024学年高一上学期期末质量检测 化学试题(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省苏州实验中学科技城校2023-2024学年高一上学期十二月份质量调研 化学试卷黑龙江省哈尔滨市第六中学校2023-2024学年高一下学期4月测试化学试卷
名校
5 . Ⅰ.部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如图所示。
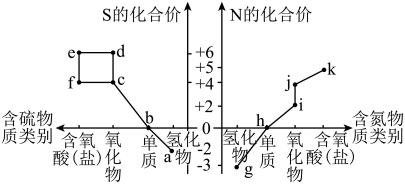
回答下列问题:
(1)j的化学名称是___________ 。
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是___________ (填字母)。
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将pH=1的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是___________ 。
Ⅱ.S4N4(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入S2Cl2的CCl4溶液中,可制得该物质:6S2Cl2+16g=S4N4+S8+12NH4Cl(已知S8是硫单质中最稳定的)。
(4)上述制备反应中,物质g体现的性质有___________ ,其中被氧化的元素是___________ (填元素符号)。
(5)S4N4在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是___________ 。
Ⅲ.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140℃反应制得,氯气过量则会生成SCl2,S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
(6)该固体是___________ (填名称)。
(7)甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案___________ (填“可行”或“不可行”),原因是___________ 。
(8)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为___________ ,由此可知产品中___________ (填“含有”或“不含有”)SCl2杂质。

回答下列问题:
(1)j的化学名称是
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将pH=1的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是
Ⅱ.S4N4(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入S2Cl2的CCl4溶液中,可制得该物质:6S2Cl2+16g=S4N4+S8+12NH4Cl(已知S8是硫单质中最稳定的)。
(4)上述制备反应中,物质g体现的性质有
(5)S4N4在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是
Ⅲ.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140℃反应制得,氯气过量则会生成SCl2,S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
(6)该固体是
(7)甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案
(8)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 下列含氮物质的性质与用途具有对应关系的是
| A.N2难溶于水,可用作粮食保护气 |
| B.NH3具有还原性,液氨可作制冷剂 |
| C.HNO3具有挥发性,可用于制造化肥 |
| D.NH4Cl溶液呈酸性,可用于去除铁锈 |
您最近一年使用:0次
2023-04-14更新
|
234次组卷
|
3卷引用:上海市静安区2022-2023学年高三下学期二模测试化学试题
上海市静安区2022-2023学年高三下学期二模测试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题6-10)宁夏银川市第二中学2023-2024学年高三上学期统练四 化学试题
7 . 二氧化氯(ClO2)是一种黄绿色、极易爆炸的强氧化性气体,易溶于水,在水中溶解度约为Cl2的5倍,其水溶液在较高温度与光照下会生成ClO 和ClO
和ClO 。实验室制备ClO2的反应为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列有关物质的性质和用途具有对应关系的是
。实验室制备ClO2的反应为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列有关物质的性质和用途具有对应关系的是
 和ClO
和ClO 。实验室制备ClO2的反应为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列有关物质的性质和用途具有对应关系的是
。实验室制备ClO2的反应为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列有关物质的性质和用途具有对应关系的是| 性质 | 用途 | |
| A | Cl2能溶于水 | 水体杀菌消毒 |
| B | ClO2有强氧化性 | 水体杀菌消毒 |
| C | HClO呈弱酸性 | 棉、麻漂白 |
| D | FeCl3(aq)呈酸性 | 蚀刻电路板上的铜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-09更新
|
149次组卷
|
3卷引用:上海民办南模中学2022-2023学年高二下学期期中考试化学试题
名校
8 . 自然界中的氮元素以氮气、氮氧化物和硝酸盐等形式存在,人类对氮元素的利用,就是实现氮元素在不同物质之间的转化。
(1)下列有关物质的性质与用途具有对应关系的是_______。
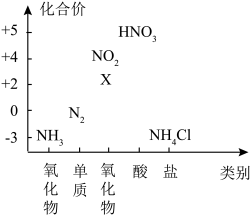
(2)下图为氮元素的价类二维图。下列说法正确的是_______。
(3)为了测定铁铜合金的组成,将15.2 g铁、铜合金加入200 mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体4.48 L(标准状况下),并测得反应后溶液中 的浓度为0.5 mol•L
的浓度为0.5 mol•L ,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。
,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。
(4)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_____ (填“浓”或“稀”)硝酸,原因是_______ 。
(5)①氨气是生产氮肥的主要原料,其电子式为_______ 。
②工业合成氨的化学方程式为_______ 。
③检验铵态氮肥中 的实验方案是
的实验方案是_______ 。
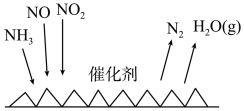
(6) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当 与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为_______ 。
(1)下列有关物质的性质与用途具有对应关系的是_______。
A. 易溶于水,可用作制冷剂 易溶于水,可用作制冷剂 | B. 具有强氧化性,可用于制 具有强氧化性,可用于制 |
C. 受热易分解,可用作化肥 受热易分解,可用作化肥 | D. 性质稳定,可用于食品保护 性质稳定,可用于食品保护 |

| A.X属于酸性氧化物 |
B. 转化为 转化为 一定需要加入氧化剂 一定需要加入氧化剂 |
C.一定条件下, 和 和 反应可以转化成 反应可以转化成 |
D.实验室采用加热分解 固体制取 固体制取 |
 的浓度为0.5 mol•L
的浓度为0.5 mol•L ,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。
,若反应前后溶液的体积变化忽略不计,则下列判断正确的是_______。A.反应后溶液中可能存在的金属阳离子有: 、 、 和 和 |
B.上述合金中铁与铜物质的量之比为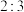 |
| C.反应后的溶液中可继续溶解铁铜合金质量最多为1.9 g |
D.原硝酸的物质的量浓度为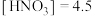 mol⋅L-1 mol⋅L-1 |
(5)①氨气是生产氮肥的主要原料,其电子式为
②工业合成氨的化学方程式为
③检验铵态氮肥中
 的实验方案是
的实验方案是(6)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当 与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
与NO的物质的量之比为1∶1时与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
您最近一年使用:0次
9 . 化学与生活关系密切,下列有关物质的性质与用途具有正确的对应关系的是
| 选项 | A | B | C | D |
| 物质 | MgO | NH4HCO3 | KAl(SO4)2·12H2O | SO2 |
| 性质 | 熔点高 | 受热易分解 | 易溶于水 | 具有氧化性 |
| 用途 | 可用作耐高温材料 | 可用作氮肥 | 可用作净水剂 | 可用于漂白纸浆 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-13更新
|
145次组卷
|
2卷引用:上海市嘉定区第二中学2023-2024学年高二上学期期中质量检测化学等级考试题
21-22高二下·山西大同·期中
名校
10 . 氧化物在生产、生活中有广泛应用。下列氧化物的性质与用途具有对应关系的是
A. 熔点高,可用于工业制备金属铝 熔点高,可用于工业制备金属铝 |
B. 易溶于水,可用于自来水消毒 易溶于水,可用于自来水消毒 |
C. 具有漂白、防腐、抗氧化,可用于葡萄酒保存 具有漂白、防腐、抗氧化,可用于葡萄酒保存 |
D. 具有强氧化性,可用作呼吸面具供氧剂 具有强氧化性,可用作呼吸面具供氧剂 |
您最近一年使用:0次



