1 . 下列物质性质与用途对应关系正确的是
| 性质 | 用途 | |
| A |  具有氧化性 具有氧化性 | 漂白纸浆 |
| B |  溶液呈弱碱性 溶液呈弱碱性 | 防火材料 |
| C |  溶液具有氧化性 溶液具有氧化性 | 蚀刻铜制电路板时作为“腐蚀液” |
| D |  具有弱酸性 具有弱酸性 | 蚀刻玻璃 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-16更新
|
78次组卷
|
2卷引用:湖南省郴州市2020-2021学年高二下学期期末考试化学试题
2 . 下列有关物质的性质与用途有对应关系的是
| A.Si有良好的半导体性能,可以用于。 |
| B.氨气具有还原性,可用作制冷剂 |
| C.Na2O2呈浅黄色,可用作潜水艇中的供氧剂 |
| D.明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂 |
您最近一年使用:0次
3 . 下列物质性质和应用都正确且有对应关系的是
| 性质 | 应用 | |
| A | 浓硫酸有强吸水性 | 可用作干燥 SO2、HCl 气体 |
| B | SiO2熔点高、硬度小 | 可用作光纤 |
| C | SO2具有漂白性 | 可使紫色石蕊试液褪为无色 |
| D | 浓硝酸具有强氧化性 | 和甲苯发生取代反应制备TNT 炸药(三硝基甲苯) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-03-27更新
|
386次组卷
|
2卷引用:湖南省郴州市嘉禾县第一中学2021-2022学年高三下学期期中考试化学试题
4 . 材料在人类文明史上起着划时代的意义,下列物品所用主要材料与类型的对应关系不正确 的是
| A | B | C | D |
 人面鱼纹陶盆 人面鱼纹陶盆 |  “马踏飞燕”铜奔马 |  宇航员的航天服 |  光导纤维 |
| 无机非金属材料 | 金属材料 | 有机高分子材料 | 复合材料 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-21更新
|
215次组卷
|
3卷引用:湖南省郴州市2021-2022学年高二下学期期末考试化学试题
解题方法
5 . 下列钠的化合物与其性质或用途不相符的是
A. ——淡黄色固体 ——淡黄色固体 | B. ——白色固体 ——白色固体 |
C. ——碱性弱,可用于制作胃药 ——碱性弱,可用于制作胃药 | D. ——受热易分解 ——受热易分解 |
您最近一年使用:0次
名校
解题方法
6 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量含氧橄榄石矿物(ZxW2-xRX4)。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料,基态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
| A.原子半径:Z>R>Y>X |
| B.X的第一电离能比同周期相邻元素小 |
| C.X的简单氢化物的热稳定性强于Y的简单氢化物 |
| D.熔点:ZY2>RX2 |
您最近一年使用:0次
2023-10-26更新
|
1047次组卷
|
7卷引用:湖南省郴州市2024届高三上学期一模化学试题
湖南省郴州市2024届高三上学期一模化学试题湖南省邵阳市绥宁县世贤中学2023-2024学年高三上学期12月月考化学试题广西名校2023-2024学年高三上学期仿真卷(一)化学试题湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届海南省海南中学高三下学期第一次模拟化学试题重庆市江北区2023-2024学年高三下学期模拟测试化学试题(七)
解题方法
7 . A~M为中学化学中常见的物质,其中A可用于焙制糕点。各物质间的转化关系如图所示。

回答下列问题:
(1)A的俗名是________ 。
(2)写出一种E的用途________ 。
(3)标准状况下,C和E的反应中,每生成2.24L氧化产物,转移的电子数是_____ 。
(4)H的化学式是_______ ,保存H溶液时常加入少量铁粉的原因是________ 。

回答下列问题:
(1)A的俗名是
(2)写出一种E的用途
(3)标准状况下,C和E的反应中,每生成2.24L氧化产物,转移的电子数是
(4)H的化学式是
您最近一年使用:0次
8 . 钢是用量最大、用途最广的合金,其主要成分为铁。其中铁的一种核素为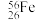 ,下列有关该核素的说法正确的是
,下列有关该核素的说法正确的是
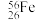 ,下列有关该核素的说法正确的是
,下列有关该核素的说法正确的是| A.质子数26 | B.中子数56 | C.质量数82 | D.电子数30 |
您最近一年使用:0次
9 . 回答下列问题:
(1)向沸水中逐滴滴加适量饱和FeCl3溶液,继续加热至液体呈透明的红褐色,形成该分散系的分散质粒子的直径范围是_______ 。利用_______ 效应,证明该分散系。
(2)①56g氮气在标准状况下的体积为_______ ;密度为_______ 。
②3.9gNa2O2中阴、阳离子的个数比为_______ 。
③现有标准状况下CO和CO2混合气体6.72L,其质量为11.6g, 则此混合气体中,CO2和CO的物质的量之比是_______ 。
(3)阅读下列《高铁酸钾使用说明书》,回答问题:
①K2FeO4中铁元素的化合价为_______ 。
②制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
③下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快,安全性好、无异味
④将K2FeO4与水反应的化学方程式补充完整:_______ 。
(1)向沸水中逐滴滴加适量饱和FeCl3溶液,继续加热至液体呈透明的红褐色,形成该分散系的分散质粒子的直径范围是
(2)①56g氮气在标准状况下的体积为
②3.9gNa2O2中阴、阳离子的个数比为
③现有标准状况下CO和CO2混合气体6.72L,其质量为11.6g, 则此混合气体中,CO2和CO的物质的量之比是
(3)阅读下列《高铁酸钾使用说明书》,回答问题:
| 高铁酸钾使用说明书 [化学式] K2FeO4 [性状]暗紫色具有金属光泽的粉末,无臭无味 [产品特点]干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 [用途]主要用于饮用水消毒净化、城市生活污水和工业污水处理 [用量]消毒净化1 L水投放5 mg K2FeO4即可达到卫生标准 |
②制备K2FeO4需要在
③下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快,安全性好、无异味
④将K2FeO4与水反应的化学方程式补充完整:
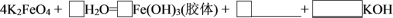
您最近一年使用:0次
14-15高二上·湖北荆州·期末
名校
解题方法
10 . NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______ (用离子方程式说明)。
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c( )
)_______ (填“等于”“大于”或“小于”)0.1mol∙L-1NH4HSO4溶液中的c( )。
)。
(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。
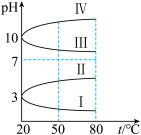
①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4Al(SO4)2溶液的pH随温度变化的原因是_______ 。
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c c
c 3cAl3=
3cAl3=_______ molL1。
(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c
 c
c 3cAl3=
3cAl3=(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2022-12-01更新
|
1390次组卷
|
57卷引用:湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题
湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷2016-2017学年内蒙古包头九中高二上10月月考化学卷2016-2017学年四川省成都七中高二上11月考试化学卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷河北省永年县第二中学2017-2018学年高二12月月考化学试题宁夏育才中学2017-2018学年高二上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题高二人教版选修4 期末学业测评(一)山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月5日 《每日一题》人教选修4-周末培优吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测四川省武胜烈面中学校2019-2020学年高二上学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》(已下线)2019年12月30日 《每日一题》人教版(选修4)——盐类水解的影响因素河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题山东省淄博市2019-2020学年高二上学期期中考试化学试题四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用安徽省皖南八校2022届高三上学期摸底联考化学试题(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)3.3.3 盐类水解的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题四川省资阳中学2021-2022学年高二下学期3月月考化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题(已下线)专题十三水溶液中的离子平衡四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题(已下线)盐类的水解黑龙江省大庆铁人中学2023-2024学年高二上学期期中考试化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷



