1 . 工业上“侯氏”制碱法制得的纯碱产品中常含有少量的NaCl。为测定纯碱产品中碳酸钠的含量,取23g样品置于烧杯中,加水将其溶解,然后逐滴滴入稀盐酸,当滴入200g稀盐酸时,两者恰好完全反应。生成的气体全部逸出,共收集到8.8g二氧化碳。求:
(1)所用稀盐酸中溶质的质量分数。_______
(2)23g样品中碳酸钠的质量分数(结果保留到0.1%)。_______
(1)所用稀盐酸中溶质的质量分数。
(2)23g样品中碳酸钠的质量分数(结果保留到0.1%)。
您最近一年使用:0次
2 . 节能、环保、高效、新材料的使用是上海世博会的亮点。
(1)上海世博园内“阳光谷"顶棚膜的生产原料之一是四氟乙烯(C2F4)。四氟乙烯由_____ 种元素组成,其中碳元素的质量分数(百分含量)为_______ 。
(2)上海世博园内有许多饮水台,可取水直接饮用。其中的饮用水处理步骤如图所示:

①其中活性炭起______ 作用;
②紫外灯发出的紫外线和氯气作用相似,起_______ 作用;
③超滤膜可以让水分子通过,其它大分子污染物则被截留,这个分离过程属于_______ (填“物理”或“化学")变化。
(1)上海世博园内“阳光谷"顶棚膜的生产原料之一是四氟乙烯(C2F4)。四氟乙烯由
(2)上海世博园内有许多饮水台,可取水直接饮用。其中的饮用水处理步骤如图所示:

①其中活性炭起
②紫外灯发出的紫外线和氯气作用相似,起
③超滤膜可以让水分子通过,其它大分子污染物则被截留,这个分离过程属于
您最近一年使用:0次
名校
3 . 硅元素有质量数为28、29、30三种同位素,硅元素的近似相对原子质量为28.1,自然界中质量数为28的硅原子百分含量为92%,则质量分数为29、30的原子个数比为
| A.3:5 | B.3:1 | C.2:3 | D.3:2 |
您最近一年使用:0次
名校
4 . 某血液化验单中,高密度酯蛋白胆固醇的含量为 ,该体检指标所采用的物理量是
,该体检指标所采用的物理量是
 ,该体检指标所采用的物理量是
,该体检指标所采用的物理量是| A.物质的量浓度 | B.摩尔质量 | C.质量分数 | D.溶解度 |
您最近一年使用:0次
2020-03-10更新
|
72次组卷
|
2卷引用:广西崇左市2019-2020学年高一上学期期末考试化学试题
5 . 在短周期元素中,(均用化学符号表示)
(1)常温下有颜色的气体单质有___________ ;
(2)除稀有气体外,原子半径最大的元素是____ ;最小的元素是____ ;
(3)气态氢化物中最稳定的是___ ,含氢的质量分数最大的是___ ,其水溶液呈碱性的元素是___ ;
(4)在最高价氧化物中呈最高正价的元素是____ ;
(5)地壳中含量最多的元素____ 。
(1)常温下有颜色的气体单质有
(2)除稀有气体外,原子半径最大的元素是
(3)气态氢化物中最稳定的是
(4)在最高价氧化物中呈最高正价的元素是
(5)地壳中含量最多的元素
您最近一年使用:0次
6 . 某常用的血液抗凝剂由(NH4)2C2O4和Na2C2O4组成,为确定其成分,某同学进行如下实验:
①氮元素测定:精确称取a g样品,加适量蒸馏水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量浓NaOH溶液,加热装置A产生水蒸气,装置B中产生的氨气全部吹出,用V1mLc1mol/L的硫酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol/LNaOH标准溶液过剩的H2SO4,到终点时消耗V2mLNaOH溶液。
②C2O42-离子的测定:取实验①B装置中剩余溶液于锥形瓶中,先用稀硫酸酸化,再用0.1000mol/L的酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液V3mL。
③计算:根据实验①计算氮元素的含量,根据②计算C2O42-的含量,从而得到样品中(NH4)2C2O4和Na2C2O4的比例。完成下列问题:

(1)装置A中长玻璃管的作用是__________________ 。
(2)用NaOH标准溶液滴定过剩H2SO4时, NaOH标准溶液盛装在_______________ 中(填仪器名称)。
(3)样品中氮元素的质量分数表达式为_________________ 。
(4)实验②中发生的离子方程式为_________________________ 。用酸性高锰酸钾溶液滴定时终点现象为_______________________ 。
(5)实验②中滴定开始和结束时,滴定管的读数如图所示,则所用酸性KMnO4溶液体积V3=____________ mL

(6)下列操作可能使实验②测定结果偏低的是______ 。
A.滴定管在注入溶液前用蒸馏水洗后未用标准溶液润洗
B.开始时酸式滴定管尖嘴部分有气泡,滴定过程中消失
C.滴定前仰视滴定管读数,滴定后平视滴定管读数
①氮元素测定:精确称取a g样品,加适量蒸馏水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量浓NaOH溶液,加热装置A产生水蒸气,装置B中产生的氨气全部吹出,用V1mLc1mol/L的硫酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol/LNaOH标准溶液过剩的H2SO4,到终点时消耗V2mLNaOH溶液。
②C2O42-离子的测定:取实验①B装置中剩余溶液于锥形瓶中,先用稀硫酸酸化,再用0.1000mol/L的酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液V3mL。
③计算:根据实验①计算氮元素的含量,根据②计算C2O42-的含量,从而得到样品中(NH4)2C2O4和Na2C2O4的比例。完成下列问题:

(1)装置A中长玻璃管的作用是
(2)用NaOH标准溶液滴定过剩H2SO4时, NaOH标准溶液盛装在
(3)样品中氮元素的质量分数表达式为
(4)实验②中发生的离子方程式为
(5)实验②中滴定开始和结束时,滴定管的读数如图所示,则所用酸性KMnO4溶液体积V3=

(6)下列操作可能使实验②测定结果偏低的是
A.滴定管在注入溶液前用蒸馏水洗后未用标准溶液润洗
B.开始时酸式滴定管尖嘴部分有气泡,滴定过程中消失
C.滴定前仰视滴定管读数,滴定后平视滴定管读数
您最近一年使用:0次
7 . 亚硝酸钠是一种工业盐,虽然和食盐很像,但有毒,不能食用。以下为亚硝酸钠的工业生产流程:
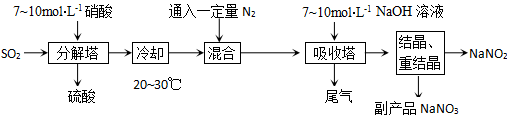
(1)首先在反应塔中通SO2和淋入硝酸,控制反应生成的NO与NO2物质的量之比恰好1:1,则分解塔中发生反应的化学方程式为:_______________ 。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是___________________ 。
(2)吸收塔中所发生化学反应方程式为:______________________ 。
(3)为测定亚硝酸钠的含量,称取4.500 g样品溶于水配成250 mL溶液,取20.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①锥形瓶中发生反应的离子方程式为________________ 。
②第一组实验数据出现异常,造成这种异常的原因可能是_________ (填代号)。
A.酸式滴定管用蒸馏水洗净后用标准液润洗
B.滴定终点时仰视读数
C.锥形瓶洗净后未干燥
③根据表中数据,计算所得固体中亚硝酸钠的质量分数__________ 。

(1)首先在反应塔中通SO2和淋入硝酸,控制反应生成的NO与NO2物质的量之比恰好1:1,则分解塔中发生反应的化学方程式为:
(2)吸收塔中所发生化学反应方程式为:
(3)为测定亚硝酸钠的含量,称取4.500 g样品溶于水配成250 mL溶液,取20.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①锥形瓶中发生反应的离子方程式为
②第一组实验数据出现异常,造成这种异常的原因可能是
A.酸式滴定管用蒸馏水洗净后用标准液润洗
B.滴定终点时仰视读数
C.锥形瓶洗净后未干燥
③根据表中数据,计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
8 . 某同学用中和滴定的方法测定混有少量Na2CO3的NaOH固体中NaOH的含量,准确称取2.0 g样品配制成200 mL溶液,然后分三次各取20.00 mL溶液于三个洁净的锥形瓶中,分别加入过量BaCl2溶液和1~2滴指示剂,用浓度为0.2000 mol·L-1的盐酸标准液进行滴定。
(1)滴定时应选用____ 作指示剂;到达滴定终点的实验现象是____ 。
(2)下列操作会导致烧碱样品中NaOH含量测定值偏高的是____ 。
E.滴定终点前加水清洗锥形瓶
F.指示剂变色后立即读数
(3)实验相关数据记录如下:
依据表中数据,计算样品中NaOH的质量分数____ 。
(1)滴定时应选用
(2)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
| A.锥形瓶未用待测液润洗 |
| B.酸式滴定管未用标准液润洗 |
| C.在滴定前有气泡,滴定后气泡消失 |
| D.滴定前平视读数,滴定结束俯视读数 |
F.指示剂变色后立即读数
(3)实验相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.60 | 20.62 |
| 2 | 20.00 | 0.80 | 20.78 |
| 3 | 20.00 | 0.20 | 20.90 |
依据表中数据,计算样品中NaOH的质量分数
您最近一年使用:0次
名校
9 . 已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈-1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
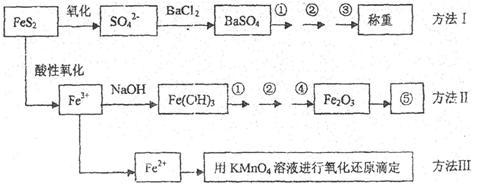
请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________ 、②___________ 、③________ 。
操作④、⑤用到的主要仪器是:④_________ 、⑤__________ (每空填1~2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是_______________________________ 。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有_______
A.砝码生锈 B.定容时俯视
C.称量时物质和砝码位置反了(需要游码) D.容量瓶用待装液润
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________ 。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________ 。

请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①
操作④、⑤用到的主要仪器是:④
(2)判断溶液中SO42-离子已沉淀完全的方法是
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A.砝码生锈 B.定容时俯视
C.称量时物质和砝码位置反了(需要游码) D.容量瓶用待装液润
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是
您最近一年使用:0次
10 . 电石中的碳化钙和水能完全反应: CaC2+2H2O→C2H2↑+Ca(OH)2
现在使该反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量。
(1)用下列仪器和导管组装该实验装置:

如果所制气体流向从左向右时,上述仪器和导管从上到下和从左到右直接连接的顺序(填各仪器、导管的序号)是:( ) 接( ) 接( ) 接( ) 接( ) 接( ) ;
(2)一般实验产生的气体含有______ (填化学式,至少2种)等杂质导致测定结果偏大,通常用______ (填化学式)溶液除去;
(3) 实验室制取乙炔时,为了______ 通常用饱和食盐水代替蒸馏水;
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是_______ 。
现在使该反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量。
(1)用下列仪器和导管组装该实验装置:

如果所制气体流向从左向右时,上述仪器和导管从上到下和从左到右直接连接的顺序(填各仪器、导管的序号)是:
(2)一般实验产生的气体含有
(3) 实验室制取乙炔时,为了
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是
您最近一年使用:0次



