2022高三·全国·专题练习
1 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中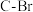 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: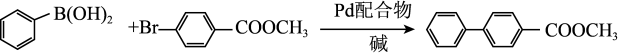
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
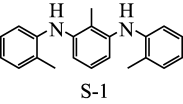
根据上述信息,甲、乙两组合成的 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

回答下列问题:
(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中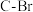 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
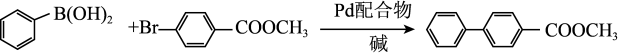
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
9057次组卷
|
15卷引用:陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题
陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
2 . 已知Na2SO3 +S= Na2S2O3,实验室用下述方法制备 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是
 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是A.①中消耗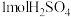 转移 转移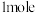 |
| B.②中溶液先变浑浊的原因:2Na2S+3SO2= 2Na2SO3+3S↓ |
C.为提高产品的纯度,混合液中 的最佳比例为1∶2 的最佳比例为1∶2 |
D.用适量 溶液吸收②中逸出的 溶液吸收②中逸出的 、 、 气体,吸收液可直接返回到步骤② 气体,吸收液可直接返回到步骤② |
您最近一年使用:0次
2023-01-14更新
|
2991次组卷
|
9卷引用:陕西省咸阳市实验中学2022-2023学年高一下学期第三次月考化学试题
名校
3 . 某固体混合物由Na2CO3和NaHCO3两种物质组成,将其分成X、Y两等份。标准状况下,X溶于足量盐酸,生成CO2的体积为V1L;Y充分加热、冷却后再溶于足量盐酸,生成CO2,的体积为V2L。下列说法正确的是
A.加热,蒸干X与足量盐酸反应后的溶液,可得固体 g g |
B.Y充分加热,固体质量减少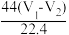 g g |
| C.X、Y消耗盐酸的物质的量之比为1:1 |
D.混合物中Na2CO3和NaHCO3的物质的量之比为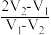 |
您最近一年使用:0次
2022-06-01更新
|
2424次组卷
|
5卷引用:陕西省安康市2022-2023学年高二下学期开学摸底考试化学试题
陕西省安康市2022-2023学年高二下学期开学摸底考试化学试题陕西省西安市西北工业大学附属中学2023-2024学年高一上学期第二次月考化学试题山东省聊城市2022届高三下学期5月三模化学试题(已下线)第07讲 钠及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题
名校
解题方法
4 . 某烃的结构简式为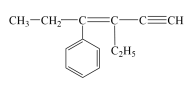 ,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
 ,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )| A.3、4、5 | B.3、10、4 |
| C.3、14、4 | D.4、10、4 |
您最近一年使用:0次
2020-05-14更新
|
6300次组卷
|
40卷引用:【全国百强校】陕西省西安市长安区第一中学2017-2018学年高一下学期期末考试(理)化学试题
【全国百强校】陕西省西安市长安区第一中学2017-2018学年高一下学期期末考试(理)化学试题2016-2017学年内蒙古赤峰二中高二上月考二化学卷广西壮族自治区贵港市覃塘高级中学2018-2019学年高二上学期9月月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二上学期第二次月考化学试题【全国百强校】江西省南昌市第十中学2018-2019学年高二下学期3月月考化学试题(已下线)2019年6月8日 《每日一题》选修5-周末培优内蒙古呼和浩特开来中学2018-2019学年高二5月期中考试化学试题云南省丘北二中2018-2019学年高二下学期期末考试化学试题河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题江西省宜春市宜丰中学2019-2020学年高二上学期第三次月考化学试题有机物分子中原子共线共面问题和芳香烃的同分异构专题-【百强校】河南省洛阳市第一高级中学高三化学复习练习云南省陆良县联办高级中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市大新县大新中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市宁明中学2019-2020学年高二上学期期末考试化学试题吉林省白城市第四中学2019-2020学年高二下学期网上阶段检测化学试题山西省长治市2019-2020学年高二下学期第一次在线月考化学试题广西隆林县第二中学2019-2020学年高二上学期期末考试化学试题福建省莆田市荔城区第二十四中学2019-2020学年高二下学期期中化学试题河北省张家口市涿鹿县涿鹿中学2019-2020学年高二下学期3月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二下学期期中考试化学试题高二选择性必修3(人教版2019)第二章 烃 专题2 有机化合物共线 共面问题的判断江西省新余市2020-2021学年高一下学期期末质量检测化学试题河北省唐山市曹妃甸第一中学2020-2021学年高一下学期6月月考化学试题(已下线)专题讲座(十) 有机物分子中原子共线、共面的判断(精练)-2022年高考化学一轮复习讲练测黑龙江省哈尔滨工业大学附属中学校2021-2022学年高二上学期期末考试化学试题(已下线)第11讲 烃的燃烧、共面问题(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)辽宁省建平县实验中学2021-2022学年高二下学期第三次月考化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二下学期期中考试化学试题上海市宝山区2022届高三模拟考试化学试题山东省青岛市2022届高三下学期五月模拟考试化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题安徽省芜湖市第一中学2022-2023学年高二上学期12月份教学质量检测化学试题河南省安阳市第一中学2023届高三第四次全真模拟化学试题(已下线)烃——课时7烃的燃烧与共面第二章 烃(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)山西省晋城市第一中学校2022-2023学年高二下学期5月月考化学试题湖北省武汉外国语学校2022-2023学年高一下学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题7.2.2 烃、有机高分子材料 随堂练习天津市崇化中学2023-2024学年高二下学期期中阶段质量监测化学试卷
名校
解题方法
5 . 如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。下列叙述不正确的是


| A.以上反应中属于氧化还原反应的有①②③④ |
B.E与C反应的离子方程式为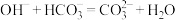 |
| C.加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为4.16 g |
D.将x mol B和y mol E在密闭容器中加热到250℃,让其充分反应,当剩余固体为 、NaOH,排出气体为 、NaOH,排出气体为 、 、 时,x/y的值可能是0.5 时,x/y的值可能是0.5 |
您最近一年使用:0次
2022-04-12更新
|
1607次组卷
|
2卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高一上学期第二次月考化学试题
名校
6 . 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
| A.生成44.8L N2(标准状况) |
| B.有0.25 mol KNO3被还原 |
| C.转移电子的物质的量为1.75mol |
| D.被氧化的N原子的物质的量为3.75mol |
您最近一年使用:0次
2019-07-05更新
|
9182次组卷
|
8卷引用:陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题
7 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
40卷引用:陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题
陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题青海省西宁二十一中2018届高三上学期12月月考化学试卷黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
名校
解题方法
8 . 下列离子方程式书写正确的是
A.将稀硫酸加入硫代硫酸钠溶液:S2O +SO +SO +4H+=2SO2↑+S↓+2H2O +4H+=2SO2↑+S↓+2H2O |
B.向酸性高锰酸钾溶液加入草酸:2C2O +2MnO +2MnO +16H+=10CO2↑+2Mn2++8H2O +16H+=10CO2↑+2Mn2++8H2O |
C.(NH4)2Fe(SO4)2溶液中滴加Ba(OH)2溶液至Fe2+恰好完全沉淀:Fe2++2SO +2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓ +2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓ |
| D.新制氯水中加入少量CaCO3:2Cl2+H2O+CaCO3=Ca2++2Cl- +CO2↑+2HClO |
您最近一年使用:0次
2022-06-11更新
|
2460次组卷
|
7卷引用:陕西省西安中学2023-2024学年高三上学期8月月考化学试题
名校
解题方法
9 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中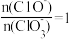 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2103次组卷
|
12卷引用:陕西省榆林中学2022-2023学年高一上学期期末考试化学试题
陕西省榆林中学2022-2023学年高一上学期期末考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
10 . 将Cl2通入含a mol NaOH的溶液中,反应会放热,温度升高后发生反应: 3Cl2+6NaOH = 5NaCl+NaClO3+3H2O。当NaOH完全反应时,下列说法正确的是
| A.反应中作氧化剂的Cl2有0.25a mol |
B.若反应后溶液中 =2,则 =2,则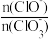 =5 =5 |
C.NaClO与NaClO3的物质的量之和可能为 a mol a mol |
D.反应中转移电子的物质的量可能为 a mol a mol |
您最近一年使用:0次
2023-05-16更新
|
944次组卷
|
3卷引用:陕西省西安铁一中滨河高级中学2023-2024学年高一上学期期中考试化学试题



