1 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
40卷引用:青海省西宁二十一中2018届高三上学期12月月考化学试卷
青海省西宁二十一中2018届高三上学期12月月考化学试卷2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
名校
2 . W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Y同族,X和Z同族,X的简单离子和Y的简单离子具有相同的电子层结构,W和X、Z均能形成共价化合物,W和X、Y分别形成的化合物溶于水均呈碱性。下列说法错误的是
| A.4种元素中Y的金属性最强 |
| B.最高价氧化物对应的水化物的酸性:Z>X |
| C.简单阳离子氧化性:W>Y |
| D.W和Y形成的化合物与水反应能生成一种还原性气体 |
您最近一年使用:0次
2019-05-24更新
|
4035次组卷
|
8卷引用:青海省西宁市海湖中学2021届高三上学期第二阶段考试化学试题
3 . A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称是_______ ,B含有的官能团是_______________ 。
(2)①的反应类型是____________ ,⑦的反应类型是________________ 。
(3)C和D的结构简式分别为______________ 、_________________ 。
(4)异戊二烯分子中最多有________ 个原子共平面,顺式聚异戊二烯的结构简式为___________ 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体__________ (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线___________________ 。

回答下列问题:
(1)A的名称是
(2)①的反应类型是
(3)C和D的结构简式分别为
(4)异戊二烯分子中最多有
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
12卷引用:2015-2016学年青海师大附二中高二下期中化学试卷
2015-2016学年青海师大附二中高二下期中化学试卷2015年全国普通高等学校招生统一考试化学(新课标I卷)2014-2015学年辽宁师大附中高二下学期期末考试化学试卷2016届福建省福安市高级中学高三3月月考化学试卷陕西省黄陵中学2016-2017学年高二(普通班)下学期期末考试化学试题重庆市垫江县2018届高三上学期模底考试理综化学试题人教版2017-2018学年高二化学同步练习:选修五 3-4-1 有机合成陕西省城固县第一中学2019届高三上学期第一次月考化学试题(已下线)2019年6月9日 《每日一题》选修5-每周一测2020届高三化学二轮对题必练——有机化学基础大题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题3.1.2有机合成路线的设计 有机合成的应用(课后)-鲁科版选择性必修3
解题方法
4 . 铜阳极泥是许多贵金属及硫(Te)的主要来源,某有色金属冶炼厂处理铜阳极泥得到的酸性分金液中主要含有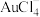 、
、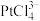 、
、 、
、 、
、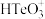 等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
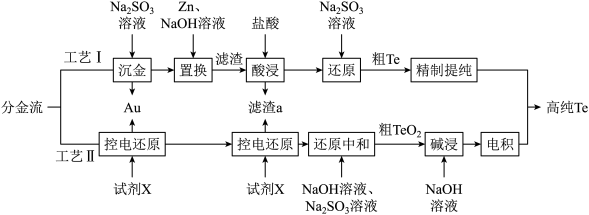
回答下列问题:
(1)Te元素的原子序数为52,则其在元素周期表中的位置为_______ 。
(2)“沉金”,时,发生反应的离子方程式为_______ 。
(3)“沉金”,及“控电还原”,所得Au中常含少量Ag。所以得Au制成的粗金板和纯金板作电极,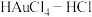 作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为
作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为_______ ;电解时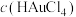 将
将_______ (填“增大”,“减小”,或“不变”)。
(4)滤渣a的主要成分为_______ (填化学式)。
(5)“控电还原”时,试剂X可选择 或
或 ,两者信息如下表所示。从价格上分析,最佳试剂为
,两者信息如下表所示。从价格上分析,最佳试剂为_______ (填化学式),按处理 年分金液的量计算,理论上每年可节约成本
年分金液的量计算,理论上每年可节约成本_______ 万元。
(6)“电积”时,阴极的电极反应式为____ ;“电积”后的电解液可用于工艺I的_____ 工序。
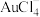 、
、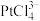 、
、 、
、 、
、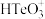 等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
回答下列问题:
(1)Te元素的原子序数为52,则其在元素周期表中的位置为
(2)“沉金”,时,发生反应的离子方程式为
(3)“沉金”,及“控电还原”,所得Au中常含少量Ag。所以得Au制成的粗金板和纯金板作电极,
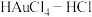 作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为
作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为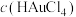 将
将(4)滤渣a的主要成分为
(5)“控电还原”时,试剂X可选择
 或
或 ,两者信息如下表所示。从价格上分析,最佳试剂为
,两者信息如下表所示。从价格上分析,最佳试剂为 年分金液的量计算,理论上每年可节约成本
年分金液的量计算,理论上每年可节约成本| 消耗物料 | 消耗量/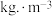 | 单价/元 |
 | 22.0 | 2.7 |
 | 13.0 | 4.2 |
您最近一年使用:0次
名校
5 . 阿伏加德罗常数的值为NA,下列叙述中错误的是
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.01×1023
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2 L氯气中含有 NA个氯原子
①标准状况下,2.24 L水中含有0.1 NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.01×1023
③2 mol NaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2 L氯气中含有 NA个氯原子
| A.①③④⑥⑧ | B.①④⑤⑥⑧ | C.①②④⑥⑧ | D.②③④⑤⑦ |
您最近一年使用:0次
2017-02-17更新
|
2985次组卷
|
16卷引用:青海省海东市第二中学2019-2020学年高一上学期期中考试化学试题
青海省海东市第二中学2019-2020学年高一上学期期中考试化学试题2016-2017学年黑龙江大庆铁人中学高一上期中化学卷陕西省西安市长安区第一中学2017-2018学年高一(实验班)上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一上学期期中考试化学试题(A)河北省高阳中学2017-2018学年高一1月月考化学试题湖北省黄冈市浠水实验高中2019-2020学年高一10月月考化学试题内蒙古包头稀土高新区二中2019-2020学年高一10月月考化学试题福建省龙海市程溪中学2019-2020学年高一上学期期中考试化学试题福建省泉州市永春第一中学2020届高三上学期期初考试化学试题湖北省黄冈市浠水县实验高级中学2019-2020学年高一上学期9月月考化学试题福建省泰宁第一中学2018-2019学年高一上学期第二阶段考试化学试题(已下线)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二6月阶段性测试化学试题(已下线)【南昌新东方】5.莲塘一中 曹永康 程秀丽广东省中山市第一中学丰山学部2019-2020学年高一上学期第三次段化学试题福建省福州市八县(市、区)协作校 2021-2022学年高一上学期11月份期中联考化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题
解题方法
6 . 氰基丙烯酸酯在碱性条件下能快速聚合为 从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
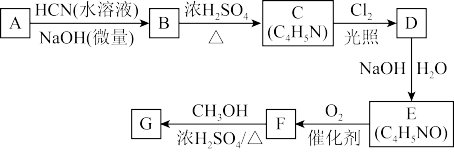
已知:①A的相对分子质量为58,分子中只含有一个氧原子,核磁共振氢谱显示为单峰
②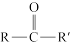

回答下列问题:
(1)A的化学名称为___________ 。
(2)B的结构简式为___________ ,其核磁共振氢谱显示为___________ 组峰,峰面积比为___________ 。
(3)由C生成D的反应类型为___________ ,由G生成聚合物的反应类型为___________ 。
(4)由D生成E的化学方程式为___________ 。
(5)G中的官能团有___________ 、___________ 、___________ 。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________ 种。(不含立体结构)
 从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
已知:①A的相对分子质量为58,分子中只含有一个氧原子,核磁共振氢谱显示为单峰
②


回答下列问题:
(1)A的化学名称为
(2)B的结构简式为
(3)由C生成D的反应类型为
(4)由D生成E的化学方程式为
(5)G中的官能团有
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有
您最近一年使用:0次
名校
7 . 对下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) |
您最近一年使用:0次
2019-01-22更新
|
938次组卷
|
2卷引用:【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期期末考试化学试题
名校
8 . 甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是
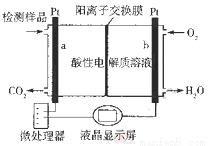

| A.该装置为电能转化为化学能的装置 |
| B.a电极发生的电极反应为CH3OH + H2O - 6e- ═ CO2↑ + 6H+ |
| C.当电路中有1 mol e-转移时,正极区n(H+)增加1 mol |
| D.将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流 |
您最近一年使用:0次
2016-06-25更新
|
1429次组卷
|
4卷引用:2015-2016学年青海师大附二中高一下期中化学试卷
2013·江苏·一模
名校
解题方法
9 . 过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:

(1)用上述方法制取CaO2·8H2O的化学方程式是___________________ 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①___________________ ;②___________________ 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为__________ 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)________
表1. KMnO4标准溶液滴定数据
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:

(1)用上述方法制取CaO2·8H2O的化学方程式是
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
表1. KMnO4标准溶液滴定数据
您最近一年使用:0次
10 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
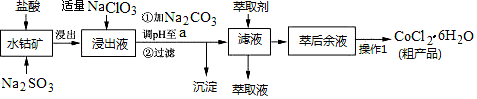
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________ 。
(2)写出NaClO3发生反应的主要离子方程式______________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为___________ 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________ ;其使用的最佳pH范围是________________ 。
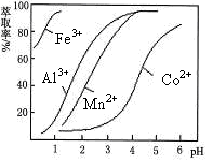
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________ 。(答一条即可)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-01-27更新
|
670次组卷
|
5卷引用:2016届青海省平安高级中学高三下4月月考化学试卷



