2025高三上·全国·专题练习
解题方法
1 . 用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次
2025高三上·全国·专题练习
2 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为___________ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
 2O3。
2O3。(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
3 . 质量、物质的量、物质的量浓度等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)标准状况下,17g NH3的体积为___________ ,含有氢原子个数为___________ ,它与标准状况下___________ L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为___________ ,R的相对原子质量为___________ 。
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为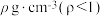 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
(6)将a L Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入b mol BaCl2溶液使溶液中的SO 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为___________ 。
(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为___________ mL。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为
(2)标准状况下,17g NH3的体积为
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为
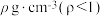 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。A.溶质的质量分数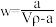 |
B.溶质的物质的量浓度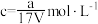 |
C.溶液密度ρ可表示为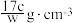 |
| D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为
您最近一年使用:0次
名校
解题方法
4 . 为测定某铝镁铜合金中铝、镁的质量分数,进行如下实验(忽略反应中水的蒸发):①向30.0g合金粉末中加入200g 30.0% NaOH溶液,充分反应后,称得固液混合物质量为227.0g。②再向混合液中加入过量稀硫酸,充分反应后剩余固体洗涤干燥后称得质量为0.6g。(计算结果保留一位小数)
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为___________ mol/L。
(2)30.0g合金中Al的质量为___________ g。
(3)合金中Mg元素的质量分数为___________ 。
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为
(2)30.0g合金中Al的质量为
(3)合金中Mg元素的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 工业上常用纯碱( )溶液吸收尾气中的NO、
)溶液吸收尾气中的NO、 。某纯碱样品中含杂质NaCl,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中
。某纯碱样品中含杂质NaCl,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中 的质量分数为
的质量分数为___________ 。
 )溶液吸收尾气中的NO、
)溶液吸收尾气中的NO、 。某纯碱样品中含杂质NaCl,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中
。某纯碱样品中含杂质NaCl,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
6 . “微生物法”处理含 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。
(1)硫酸盐还原菌能将水中的 转化为
转化为 ,
, 与
与 可反应生成
可反应生成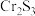 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在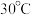 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是___________ 。
(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为___________ 。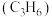 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。___________ ,乙为___________ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为___________ 。
 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。(1)硫酸盐还原菌能将水中的
 转化为
转化为 ,
, 与
与 可反应生成
可反应生成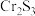 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在
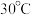 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的
 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为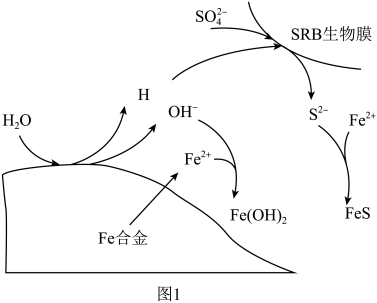
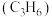 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。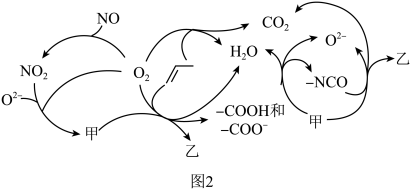
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 天然气的主要成分为 ,一般还含有
,一般还含有 、
、 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:
 ,相关物质的摩尔燃烧焓数据如表所示:
,相关物质的摩尔燃烧焓数据如表所示:
则
_____ 
(2)甲烷是常见的燃料, 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为
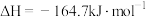 。
。
①
_____ 。
②对于 加氢制备甲烷的反应,有关说法错误的是
加氢制备甲烷的反应,有关说法错误的是_____ 。
A.该反应理论上可以设计成原电池
B.该反应过程中有旧键断裂吸收的能量大于新键形成释放的能量
C.反应结束,体系中物质的总能量降低
D.此反应可以变废为宝,有利于碳中和和碳达峰的实现
③已知:标准摩尔生成焓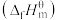 是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
则
_____ 。
(3)丙烷燃烧可以通过以下两种途径:
途径I:
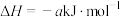
途径Ⅱ: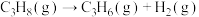
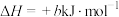

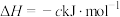

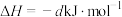 (a、b、c、d均为正值)
(a、b、c、d均为正值)
按途径Ⅱ反应,常温下,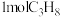 完全燃烧时放出的热量为
完全燃烧时放出的热量为_____ kJ(用含b、c、d的代数式表示);相同条件下,等量的丙烷通过两种途径完全燃烧时,途径I放出的热量_____ (填“大于”、“小于”或“等于”)途径Ⅱ放出的热量。
 ,一般还含有
,一般还含有 、
、 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。(1)乙烷在一定条件可发生如下反应:

 ,相关物质的摩尔燃烧焓数据如表所示:
,相关物质的摩尔燃烧焓数据如表所示:| 物质 | 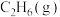 | 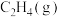 |  |
摩尔燃烧焓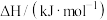 | -1560 | -1411 | -286 |


(2)甲烷是常见的燃料,
 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为
 。
。| 物质 |  |  |  |  |
| 键能:1mol化学键断裂时需要吸收的能量/kJ | 436 | 465 | 413 | a |

②对于
 加氢制备甲烷的反应,有关说法错误的是
加氢制备甲烷的反应,有关说法错误的是A.该反应理论上可以设计成原电池
B.该反应过程中有旧键断裂吸收的能量大于新键形成释放的能量
C.反应结束,体系中物质的总能量降低
D.此反应可以变废为宝,有利于碳中和和碳达峰的实现
③已知:标准摩尔生成焓
 是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:
是指标况下,由元素最稳定的单质生成1mol纯净物时的反应焓变。298K时,几种气态物质标准摩尔生成焓如表:| 物质 |  |  |  |  |
 | -393.5 | -241.5 | x | 0 |

(3)丙烷燃烧可以通过以下两种途径:
途径I:

途径Ⅱ:
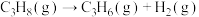
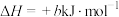

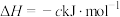

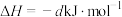 (a、b、c、d均为正值)
(a、b、c、d均为正值)按途径Ⅱ反应,常温下,
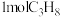 完全燃烧时放出的热量为
完全燃烧时放出的热量为
您最近一年使用:0次
8 .  可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与
可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与 溶液反应):
溶液反应):
Ⅰ.取0.68000 g 产品,与足量
产品,与足量 溶液充分反应后。
溶液充分反应后。
Ⅱ.将生成的CuS置于已恒重、质量为31.230 g的坩埚中煅烧,恒重后总质量为32.814 g。
请计算:
(1)实验过程中化学科研工作者使用了950 mL 0.60000 mol/L 溶液,该试剂的物质的量为
溶液,该试剂的物质的量为___________ mol。
(2)Ⅱ中CuS煅烧成CuO,CuO的物质的量为___________ mol。
(3)产品中硫化氢的质量分数为___________ 。
 可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与
可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与 溶液反应):
溶液反应):Ⅰ.取0.68000 g
 产品,与足量
产品,与足量 溶液充分反应后。
溶液充分反应后。Ⅱ.将生成的CuS置于已恒重、质量为31.230 g的坩埚中煅烧,恒重后总质量为32.814 g。
请计算:
(1)实验过程中化学科研工作者使用了950 mL 0.60000 mol/L
 溶液,该试剂的物质的量为
溶液,该试剂的物质的量为(2)Ⅱ中CuS煅烧成CuO,CuO的物质的量为
(3)产品中硫化氢的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理为:
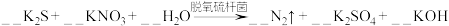 。
。
(1)配平上述反应方程式,并用单线桥标出电子转移的方向和数目___________ 。
(2)被氧化的元素是___________ 。
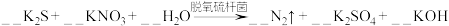 。
。(1)配平上述反应方程式,并用单线桥标出电子转移的方向和数目
(2)被氧化的元素是
您最近一年使用:0次
名校
解题方法
10 . 把1L 1.0mol/L 溶液和1L 1.0mol/L
溶液和1L 1.0mol/L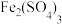 溶液混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足量的时间,铁粉有剩余。请计算:
溶液混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足量的时间,铁粉有剩余。请计算:
(1)溶液混合前 的物质的量是
的物质的量是___________ mol。
(2)反应后 的物质的量浓度是
的物质的量浓度是___________ mol/L。
(3)反应中消耗铁粉的质量是___________ g。
 溶液和1L 1.0mol/L
溶液和1L 1.0mol/L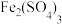 溶液混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足量的时间,铁粉有剩余。请计算:
溶液混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足量的时间,铁粉有剩余。请计算:(1)溶液混合前
 的物质的量是
的物质的量是(2)反应后
 的物质的量浓度是
的物质的量浓度是(3)反应中消耗铁粉的质量是
您最近一年使用:0次



