名校
解题方法
1 . 分子式为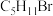 的烃,分子中含有3个甲基的同分异构体共有(不考虑立体异构)
的烃,分子中含有3个甲基的同分异构体共有(不考虑立体异构)
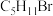 的烃,分子中含有3个甲基的同分异构体共有(不考虑立体异构)
的烃,分子中含有3个甲基的同分异构体共有(不考虑立体异构)| A.3种 | B.2种 | C.5种 | D.4种 |
您最近一年使用:0次
2024-05-08更新
|
99次组卷
|
8卷引用:2.1.2同分异构体 课前
名校
解题方法
2 . 已知 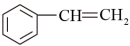 (x)、
(x)、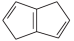 (y)、
(y)、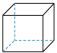 (z)互为同分异构体,下列说法不正确的是
(z)互为同分异构体,下列说法不正确的是
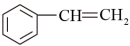 (x)、
(x)、 (y)、
(y)、 (z)互为同分异构体,下列说法不正确的是
(z)互为同分异构体,下列说法不正确的是| A.z的二氯代物有三种 |
| B.z、y的一氯代物均只有三种 |
| C.x、y可使溴的四氯化碳溶液因发生加成反应而褪色 |
| D.x、y中的所有原子可能处于同一平面 |
您最近一年使用:0次
名校
3 . 下列实验能获得成功的是
| A.蔗糖溶液中加入稀硫酸,加热,然后加入银氨溶液,水浴加热,有银镜生成 |
| B.在硫酸铜溶液中加入几滴稀NaOH溶液后,加入葡萄糖溶液,煮沸后,有砖红色沉淀析出 |
| C.在淀粉溶液中加入唾液(含淀粉酶),水浴加热(36℃左右),冷却后加入银氨溶液,再水浴加热,有银镜生成 |
| D.在淀粉溶液中加入稀硫酸,微热后,再加入新制的Cu(OH)2,无明显现象,说明淀粉没有水解 |
您最近一年使用:0次
解题方法
4 . 下列说法不正确的是
①有机物CH3CH3与甲烷是同系物;
②CH3COOCH2CH3和CH3CH2COOCH3是不同物质;
③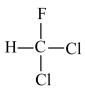 与
与 是同分异构体;
是同分异构体;
④CH3CH2OH和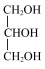 具有相同的官能团,互为同系物。
具有相同的官能团,互为同系物。
①有机物CH3CH3与甲烷是同系物;
②CH3COOCH2CH3和CH3CH2COOCH3是不同物质;
③
 与
与 是同分异构体;
是同分异构体;④CH3CH2OH和
 具有相同的官能团,互为同系物。
具有相同的官能团,互为同系物。| A.③④ | B.②③④ | C.①④ | D.全部 |
您最近一年使用:0次
5 . 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。
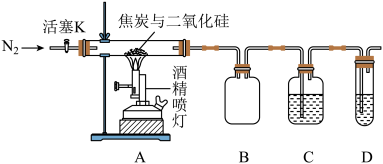
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O=CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是___________ 。
(2)装置B的作用是___________ 。
(3)装置C、D中所盛试剂分别为___________ 、___________ ,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为___________ 。
(4)该装置的缺点是___________ 。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC.取36gSiO2和16.8g焦炭充分反应后收集到标准状况下的气体26.88L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为___________ 。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O=CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是
(2)装置B的作用是
(3)装置C、D中所盛试剂分别为
(4)该装置的缺点是
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC.取36gSiO2和16.8g焦炭充分反应后收集到标准状况下的气体26.88L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为
您最近一年使用:0次
6 . A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
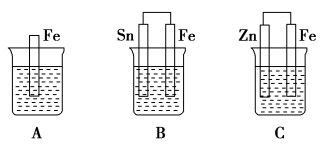
(1)A中反应的离子方程式为___________ 。
(2)B中锡极为________ 极,电极反应式为_________ ,锡极附近溶液的酸性_________ (填“增强”“减弱”或“不变”)。B中Fe极为________ 极,电极反应式为_________ 。
(3)C中被氧化的金属是___________ ,总反应的化学方程式为___________ 。
(4)A、B、C中铁被氧化由快到慢的顺序是___________ 。

(1)A中反应的离子方程式为
(2)B中锡极为
(3)C中被氧化的金属是
(4)A、B、C中铁被氧化由快到慢的顺序是
您最近一年使用:0次
7 . 工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示。下列描述正确的是
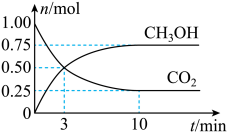

| A.达到平衡时,H2的转化率为25% |
| B.3min时,CH3OH和CO2的浓度相等,达到了化学平衡状态 |
| C.反应进行到10min时,CO2的正逆反应速率相等,反应停止 |
| D.反应开始到10min,用CO2表示的反应速率为0.0375mol·L-1·min-1 |
您最近一年使用:0次
8 . 如图所示是某同学利用注射器设计的简易实验装置。加热分离出可燃冰中的甲烷,将10mL甲烷注入甲注射器中,在同温、同压下向乙注射器中注入50mLCl2,将乙注射器中气体推入甲注射器中,用日光照射甲注射器一段时间,气体在甲注射器中发生反应。
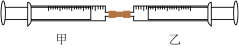
(1)下列是某同学预测的实验现象,其中正确的是___________(填字母)。
(2)甲注射器中发生的化学反应类型为___________ 。
(3)反应后,甲注射器中剩余气体最好用___________(填字母)吸收。

(1)下列是某同学预测的实验现象,其中正确的是___________(填字母)。
| A.气体最终变为无色 |
| B.实验过程中,甲注射器活塞向右移动 |
| C.甲注射器内壁有油状液滴产生 |
| D.产生火花 |
(2)甲注射器中发生的化学反应类型为
(3)反应后,甲注射器中剩余气体最好用___________(填字母)吸收。
| A.水 | B.氢氧化钠溶液 |
| C.硝酸银溶液 | D.饱和食盐水 |
您最近一年使用:0次
9 . 化学反应的速率与限度在社会生产、生活和科学研究中具有广泛的应用,对人类文明的进步和现代化建设具有重大的价值,与我们每个人息息相关。恒温条件下,在5L恒容密闭容器内充入1.5molX(g)与2.0molY(g),反应10min后达到平衡,此时X的物质的量减少1mol,Y的物质的量浓度为0.2mol·L-1,0~10min内,生成Z的平均反应速率为0.04mol·L-1·min-1。请回答下列问题:
(1)该反应的化学方程式为___________ 。
(2)0~10min内,v(Y)=___________ mol·L-1·min-1。
(3)反应达到平衡状态时,X、Y的转化率分别为___________ 、___________ (保留三位有效数字)。
(4)298K时,将一定物质的量浓度的Na3AsO3、I2和NaOH三种溶液混合,发生反应:AsO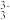 (aq)+I2(aq)+2OH-(aq)⇌AsO
(aq)+I2(aq)+2OH-(aq)⇌AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
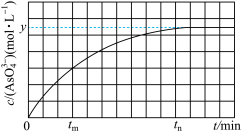
①tm时,v(正)___________ v(逆)(填“>”“<”或“=”)。
②从0到tn时,v(OH-)=___________ 。
③下列可判断反应达到平衡的是___________ (填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO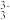 ) c.
) c.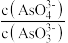 不再变化
不再变化
(1)该反应的化学方程式为
(2)0~10min内,v(Y)=
(3)反应达到平衡状态时,X、Y的转化率分别为
(4)298K时,将一定物质的量浓度的Na3AsO3、I2和NaOH三种溶液混合,发生反应:AsO
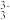 (aq)+I2(aq)+2OH-(aq)⇌AsO
(aq)+I2(aq)+2OH-(aq)⇌AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①tm时,v(正)
②从0到tn时,v(OH-)=
③下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO
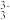 ) c.
) c.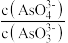 不再变化
不再变化
您最近一年使用:0次
解题方法
10 . 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
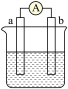
(1)当电极a为Zn,电极b为Cu,电解质溶液为CuSO4溶液时,正极的电极反应式为_______ 。若初始时两电极质量相等,当电路中有2mole-通过时,两极的质量差为_________ g。
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为______ 。当反应中收集到标准状况下336mL气体时,消耗负极的物质的量为________ mol。

(1)当电极a为Zn,电极b为Cu,电解质溶液为CuSO4溶液时,正极的电极反应式为
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为
您最近一年使用:0次



