1 . 过一硫酸氢钾(KHSO5)具有极强的水溶性和腐蚀性,是一种常见的消毒剂。实验室常用过一硫酸与碳酸钾制取过一硫酸氢钾,制取装置及步骤如下:
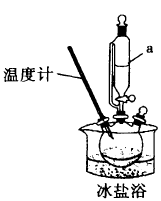
Ⅰ.将一定量已预冷的双氧水溶液加入三颈烧瓶,放入冰盐浴中,加入双氧水稳定剂,不断搅拌并缓慢加浓硫酸,制取过一硫酸。
Ⅱ.分批向三颈烧瓶中加入碳酸钾固体,保持一定温度下,搅拌30分钟。
Ⅲ.将粗产品低温冷却结晶,过滤,用无水乙醇洗涤沉淀,烘干,得过一硫酸氢钾。
回答下列问题:
(1)步骤Ⅰ制取过一硫酸的化学方程式为___________ 。
(2)指出装置图中的一处明显错误___________ ;仪器a的名称是___________ 。
(3)过一硫酸氢钾产物产率(以活性氧含量表示)随温度、稳定剂种类的变化如表:
根据实验数据分析,制备过一硫酸氢钾的最优条件为___________ 、___________ 。
(4)过滤后,用无水乙醇替代蒸馏水洗涤沉淀的目的是___________ 。
(5)测定过一硫酸氢钾(KHSO5)的质量分数。
①称量m g样品配制成500 mL溶液,取50 mL溶液于锥形瓶中,加入稀硫酸酸化,用c mol/L标准KMnO4溶液滴定至终点,滴定终点的现象为___________ 。
②若消耗KMnO4溶液V mL,则该样品中过一硫酸氢钾的质量分数表达式为___________ 。
(已知 )
)

Ⅰ.将一定量已预冷的双氧水溶液加入三颈烧瓶,放入冰盐浴中,加入双氧水稳定剂,不断搅拌并缓慢加浓硫酸,制取过一硫酸。
Ⅱ.分批向三颈烧瓶中加入碳酸钾固体,保持一定温度下,搅拌30分钟。
Ⅲ.将粗产品低温冷却结晶,过滤,用无水乙醇洗涤沉淀,烘干,得过一硫酸氢钾。
回答下列问题:
(1)步骤Ⅰ制取过一硫酸的化学方程式为
(2)指出装置图中的一处明显错误
(3)过一硫酸氢钾产物产率(以活性氧含量表示)随温度、稳定剂种类的变化如表:
| 稳定剂种类 | 活性氧含量/% | ||||
| -12℃ | -8℃ | -4℃ | 0℃ | 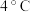 | |
| 水杨酸 | 2.3 | 2.9 | 3.6 | 2.2 | 1.4 |
| 聚乙二醇 | 2.6 | 3.1 | 3.8 | 2.7 | 1.9 |
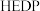 | 3.3 | 3.8 | 4.5 | 3.3 | 2.7 |
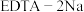 | 2.6 | 3.2 | 4.2 | 2.5 | 2.2 |
(4)过滤后,用无水乙醇替代蒸馏水洗涤沉淀的目的是
(5)测定过一硫酸氢钾(KHSO5)的质量分数。
①称量m g样品配制成500 mL溶液,取50 mL溶液于锥形瓶中,加入稀硫酸酸化,用c mol/L标准KMnO4溶液滴定至终点,滴定终点的现象为
②若消耗KMnO4溶液V mL,则该样品中过一硫酸氢钾的质量分数表达式为
(已知
 )
)
您最近一年使用:0次
解题方法
2 . 三氯化六氨合钴(Ⅲ){ ,钴为
,钴为 }价在钴化合物的合成中是重要原料。实验室以
}价在钴化合物的合成中是重要原料。实验室以 为原料制备
为原料制备 ,步骤如下:
,步骤如下:
I. 的制备。
的制备。
 可以通过钴和氯气反应制得,实验室制备纯净
可以通过钴和氯气反应制得,实验室制备纯净 可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,
可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化, 易潮解)。
易潮解)。
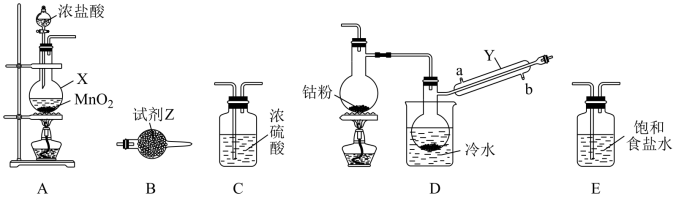
(1)仪器X的名称为________________ 。
(2)X中发生的离子方程式为________________________________ 。
(3)装置的连接顺序为A
________  B(按气流方向,用大写字母表示);反应开始前应先点燃A处的酒精灯,其目的是
B(按气流方向,用大写字母表示);反应开始前应先点燃A处的酒精灯,其目的是________________ 。
II.三氯化六氨合钴(Ⅲ)的制备。
在 锥形瓶内加入
锥形瓶内加入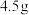 研细的二氯化钴
研细的二氯化钴 ,
, 和
和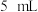 水,加热溶解后加入
水,加热溶解后加入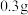 活性炭作催化剂,冷却后,通入足量
活性炭作催化剂,冷却后,通入足量 ,混合均匀;控制温度在10℃以下,缓慢加入
,混合均匀;控制温度在10℃以下,缓慢加入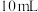 10%的
10%的 ,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。
,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。
回答下列问题:
(1)该过程中控制温度为60℃的方法是________________________ 。
(2)制备三氯化六氨合钴(Ⅲ)的总反应化学方程式为________ 。
III.测定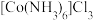 中钴的含量。
中钴的含量。
原理:利用 能将
能将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用 标准溶液滴定生成的
标准溶液滴定生成的 ,
, 所得产物为
所得产物为 。若称取样品的质量为
。若称取样品的质量为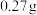 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。{提示:
。{提示: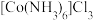 转化成
转化成 的反应为:
的反应为: 、
、 。}
。}
回答下列问题:
(1)该氧化还原滴定指示剂为________________________ 。
(2)该产品中钴元素的质量分数为________ 。
 ,钴为
,钴为 }价在钴化合物的合成中是重要原料。实验室以
}价在钴化合物的合成中是重要原料。实验室以 为原料制备
为原料制备 ,步骤如下:
,步骤如下:I.
 的制备。
的制备。 可以通过钴和氯气反应制得,实验室制备纯净
可以通过钴和氯气反应制得,实验室制备纯净 可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,
可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化, 易潮解)。
易潮解)。
(1)仪器X的名称为
(2)X中发生的离子方程式为
(3)装置的连接顺序为A

 B(按气流方向,用大写字母表示);反应开始前应先点燃A处的酒精灯,其目的是
B(按气流方向,用大写字母表示);反应开始前应先点燃A处的酒精灯,其目的是II.三氯化六氨合钴(Ⅲ)的制备。
在
 锥形瓶内加入
锥形瓶内加入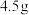 研细的二氯化钴
研细的二氯化钴 ,
, 和
和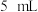 水,加热溶解后加入
水,加热溶解后加入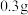 活性炭作催化剂,冷却后,通入足量
活性炭作催化剂,冷却后,通入足量 ,混合均匀;控制温度在10℃以下,缓慢加入
,混合均匀;控制温度在10℃以下,缓慢加入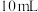 10%的
10%的 ,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。
,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(1)该过程中控制温度为60℃的方法是
(2)制备三氯化六氨合钴(Ⅲ)的总反应化学方程式为
III.测定
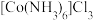 中钴的含量。
中钴的含量。原理:利用
 能将
能将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用 标准溶液滴定生成的
标准溶液滴定生成的 ,
, 所得产物为
所得产物为 。若称取样品的质量为
。若称取样品的质量为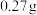 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。{提示:
。{提示: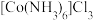 转化成
转化成 的反应为:
的反应为: 、
、 。}
。}回答下列问题:
(1)该氧化还原滴定指示剂为
(2)该产品中钴元素的质量分数为
您最近一年使用:0次
3 . 硫氰化铵( )可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为:
)可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为:
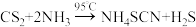 。
。
步骤1:将装置Ⅰ中药品A以恒定的速度滴入装有药品B的烧瓶中,确保有稳定的氨气缓慢通入装置Ⅱ;
步骤2:装置Ⅱ加热至95°C,发生反应,观察到装置Ⅱ下层液体逐渐减少,直至近乎消失时停止通入氨气。

回答下列问题:
(1)仪器a的名称为___________ 。装置Ⅰ中所盛装的药品A、B分别为___________ 。
(2)装置Ⅱ中加入 的目的是
的目的是___________ 。
(3)反应开始后,为加快反应速率同时控制反应温度,装置Ⅱ可以采用的加热方式是___________ 。
(4)装置Ⅲ中盛放的溶液可以是___________ ,发生反应的离子方程式为___________ 。
(5)该实验小组同学为检验生成的产物,设计了如下实验探究。
①取少量Ⅱ中反应后的溶液于试管中,滴加___________ 溶液,振荡,出现现象___________ ,得出结论产物中含有 。
。
②设计实验证明产物中存在 :
:___________ (简述实验操作及现象)。
 )可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为:
)可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为: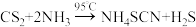 。
。步骤1:将装置Ⅰ中药品A以恒定的速度滴入装有药品B的烧瓶中,确保有稳定的氨气缓慢通入装置Ⅱ;
步骤2:装置Ⅱ加热至95°C,发生反应,观察到装置Ⅱ下层液体逐渐减少,直至近乎消失时停止通入氨气。

回答下列问题:
(1)仪器a的名称为
(2)装置Ⅱ中加入
 的目的是
的目的是(3)反应开始后,为加快反应速率同时控制反应温度,装置Ⅱ可以采用的加热方式是
(4)装置Ⅲ中盛放的溶液可以是
(5)该实验小组同学为检验生成的产物,设计了如下实验探究。
①取少量Ⅱ中反应后的溶液于试管中,滴加
 。
。②设计实验证明产物中存在
 :
:
您最近一年使用:0次
解题方法
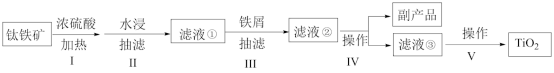
4 . 钛白粉(主要成分是 ),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁
),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁 ,含
,含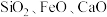 杂质]为主要原料生产钛白粉并获得副产品
杂质]为主要原料生产钛白粉并获得副产品 的工艺流程图。
的工艺流程图。
已知:发生的主要反应方程式如下:
①
②
③
(1)为加快钛铁矿在硫酸中的溶解,可采取的措施有______ 。
(2)下列说法正确的是_______ 。
A.步骤Ⅱ抽滤得到的滤渣是
B.步骤Ⅱ水浸时温度不宜过高,否则会导致 产率降低
产率降低
C.步骤Ⅱ、Ⅲ抽滤时选用的滤纸要小于布氏漏斗内径,但必须盖住所有小孔
D.步骤Ⅲ加铁屑的作用是将 还原为
还原为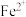 ,以获得较纯净的副产品
,以获得较纯净的副产品
(3)步骤V包括钛盐的水解、产物的分离和物质的转化。操作步骤如下:_____→_____→____→____→将滤渣在坩埚中充分灼烧得到二氧化钛(TiO2),_____ 。
①将下列操作按合理顺序填入以上空格。
a.用滤液淋洗锥形瓶,直到所有的沉淀被收集到布氏漏斗中,继续抽滤;
b.将滤液③加到盛有沸水的锥形瓶中,搅拌、煮沸;
c.用水洗涤沉淀2-3次,再抽干水分;
d.将悬浊液转移到布氏漏斗中抽滤;
②关于上述灼烧操作,下列相关说法正确的是_______
A.坩埚洗净擦干后,即可加入固体灼烧
B.将盛有固体的坩埚放在三脚架的石棉网上加热
C.灼烧固体过程中,需要不断搅拌
D.判断固体是否完全分解,可以重复灼烧、冷却、称量至恒重
(4)测定样品中TiO2纯度的方法是:
步骤一:精确称取0.2000g样品放入锥形瓶中,一定条件下,将TiO2溶解并还原为Ti3+。
步骤二:称取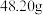 硫酸铁铵
硫酸铁铵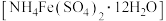 配制成
配制成 硫酸铁铵标准溶液。
硫酸铁铵标准溶液。
步骤三:滴加 溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知:
溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知: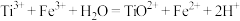 )。
)。
请回答:
①样品中TiO2的质量分数为_____ 。
②步骤三滴定过程中速度过慢,将导致测定结果_ (填“偏高”“偏低”或“无影响”)。请说明理由_ 。
 ),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁
),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁 ,含
,含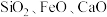 杂质]为主要原料生产钛白粉并获得副产品
杂质]为主要原料生产钛白粉并获得副产品 的工艺流程图。
的工艺流程图。
已知:发生的主要反应方程式如下:
①

②

③

(1)为加快钛铁矿在硫酸中的溶解,可采取的措施有
(2)下列说法正确的是
A.步骤Ⅱ抽滤得到的滤渣是

B.步骤Ⅱ水浸时温度不宜过高,否则会导致
 产率降低
产率降低C.步骤Ⅱ、Ⅲ抽滤时选用的滤纸要小于布氏漏斗内径,但必须盖住所有小孔
D.步骤Ⅲ加铁屑的作用是将
 还原为
还原为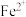 ,以获得较纯净的副产品
,以获得较纯净的副产品
(3)步骤V包括钛盐的水解、产物的分离和物质的转化。操作步骤如下:_____→_____→____→____→将滤渣在坩埚中充分灼烧得到二氧化钛(TiO2),
①将下列操作按合理顺序填入以上空格。
a.用滤液淋洗锥形瓶,直到所有的沉淀被收集到布氏漏斗中,继续抽滤;
b.将滤液③加到盛有沸水的锥形瓶中,搅拌、煮沸;
c.用水洗涤沉淀2-3次,再抽干水分;
d.将悬浊液转移到布氏漏斗中抽滤;
②关于上述灼烧操作,下列相关说法正确的是
A.坩埚洗净擦干后,即可加入固体灼烧
B.将盛有固体的坩埚放在三脚架的石棉网上加热
C.灼烧固体过程中,需要不断搅拌
D.判断固体是否完全分解,可以重复灼烧、冷却、称量至恒重
(4)测定样品中TiO2纯度的方法是:
步骤一:精确称取0.2000g样品放入锥形瓶中,一定条件下,将TiO2溶解并还原为Ti3+。
步骤二:称取
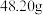 硫酸铁铵
硫酸铁铵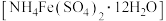 配制成
配制成 硫酸铁铵标准溶液。
硫酸铁铵标准溶液。步骤三:滴加
 溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知:
溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知: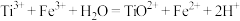 )。
)。请回答:
①样品中TiO2的质量分数为
②步骤三滴定过程中速度过慢,将导致测定结果
您最近一年使用:0次
名校
解题方法
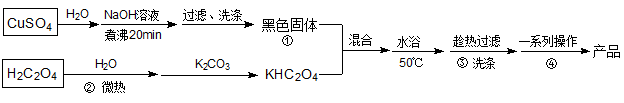
5 . K2[Cu(C2O4)2]·2H2O(二草酸合铜酸钾,式量为354)为蓝色晶体,是一种具有还原性配体的有机金属化合物。它可溶于热水,微溶于冷水、酒精,干燥时较为稳定,加热时易分解。某小组制备并探究二草酸合铜酸钾热分解的产物、测定草酸根配体的含量。制备流程如图所示:
已知:①H2C2O4 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
②Cu2++4NH3·H2O [Cu(NH3)4]2++4H2O
[Cu(NH3)4]2++4H2O
③杂质受热不分解
回答下列问题:
(1)①处“黑色固体”的化学式为___ 。
(2)②处采用“微热”溶解草酸,其原因是加快溶解速率、___ 。③处最适宜的洗涤试剂为___ 。
(3)按如图所示探究二草酸合铜酸钾晶体的热分解产物,装置B、C、F中均盛有足量的澄清石灰水,装置E中填有精细氧化铜粉末(石棉绒作载体)。
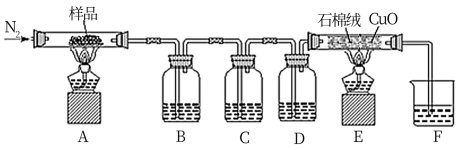
①通入氮气的目的是___ 。
②装置D中盛放的试剂是___ 。
③实验中观察到装置C中澄清石灰水未变浑浊,B、F中澄清石灰水均变浑浊,离心分离后测得沉淀质量相等,装置E中固体变为砖红色。由此推断二草酸合铜酸钾晶体热分解的化学方程式为___ 。
(4)室温下准确称取制取的晶体试样1.000g溶于氨水(1:1)中,并加水定容至250mL。取试样溶液25.00mL于锥形瓶中,再加入10mL3mol/L的H2SO4溶液,水浴加热至75~85℃,趁热用0.0100mol/L的KMnO4溶液滴定。平行滴定三次,KMnO4标准液平均消耗20.00mL。
①样品能溶解于氨水的原因是___ 。
②滴定终点的现象为___ 。
③该产品的纯度为___ 。

已知:①H2C2O4
 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O②Cu2++4NH3·H2O
 [Cu(NH3)4]2++4H2O
[Cu(NH3)4]2++4H2O③杂质受热不分解
回答下列问题:
(1)①处“黑色固体”的化学式为
(2)②处采用“微热”溶解草酸,其原因是加快溶解速率、
(3)按如图所示探究二草酸合铜酸钾晶体的热分解产物,装置B、C、F中均盛有足量的澄清石灰水,装置E中填有精细氧化铜粉末(石棉绒作载体)。

①通入氮气的目的是
②装置D中盛放的试剂是
③实验中观察到装置C中澄清石灰水未变浑浊,B、F中澄清石灰水均变浑浊,离心分离后测得沉淀质量相等,装置E中固体变为砖红色。由此推断二草酸合铜酸钾晶体热分解的化学方程式为
(4)室温下准确称取制取的晶体试样1.000g溶于氨水(1:1)中,并加水定容至250mL。取试样溶液25.00mL于锥形瓶中,再加入10mL3mol/L的H2SO4溶液,水浴加热至75~85℃,趁热用0.0100mol/L的KMnO4溶液滴定。平行滴定三次,KMnO4标准液平均消耗20.00mL。
①样品能溶解于氨水的原因是
②滴定终点的现象为
③该产品的纯度为
您最近一年使用:0次
2021-05-11更新
|
432次组卷
|
3卷引用:吉林省东北师范大学附属中学2021届高三下学期第四次模拟考试理科综合化学试题



