解题方法
1 . Ⅰ.铁是一种常见的金属,它的单质及化合物在生活生产中处处可见。
(1)苹果中含有丰富的铁元素,新榨的苹果汁是浅绿色的,在空气中久置后会变成黄色,原因是___________ ,若再向其中加入少量的维生素C,又将恢复浅绿色,上述过程中,氧气是___________ 剂(选填“氧化”或“还原”,下同),维生素C是___________ 剂。
Ⅱ.铁及其重要化合物的“价类二维图”如下图所示。

(2)该“价类二维图”中缺失的类别A应为___________ 。
(3)要实现Fe转化为Fe3O4,除了将Fe与氧气点燃外,另外的方法是(写出化学方程式)___________ 。
(4)下列关于金属冶炼的说法中正确的是____;
(5)有关合金的说法错误的是____。
(6)生活中的钢铁制品如废旧铁锅,使用时间长久后若要丢弃,应归为____。
(7)在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成而制得红色砖瓦____。
(8)要实现Fe转化为Fe2+,可选用足量的____。
(9)下列各组离子在溶液中能大量共存的是____。
(10)有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是____。
Ⅲ.某化学兴趣小组同学设计以下实验探究氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图)

(11)FeSO4可由铁粉还原Fe2(SO4)3制得,反应的离子方程式是:___________ 。
(12)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为___________ 。
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。

(13)实验时,先___________ (填“打开”或“关闭”)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,___________ (填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能持续一段时间不变色。
(1)苹果中含有丰富的铁元素,新榨的苹果汁是浅绿色的,在空气中久置后会变成黄色,原因是
Ⅱ.铁及其重要化合物的“价类二维图”如下图所示。

(2)该“价类二维图”中缺失的类别A应为
(3)要实现Fe转化为Fe3O4,除了将Fe与氧气点燃外,另外的方法是(写出化学方程式)
(4)下列关于金属冶炼的说法中正确的是____;
| A.通过电解饱和食盐水制备金属钠 |
| B.热还原法常用的还原剂有CO、H2、C等 |
| C.金属Mg、Al均能通过电解熔融氯化物的方法获得 |
| D.人类历史上金属被发现的顺序与金属的活泼性无关 |
(5)有关合金的说法错误的是____。
| A.熔点通常低于组成金属 | B.任意两种金属均可以形成合金 |
| C.钢比生铁的含碳量低 | D.可能含有非金属 |
(6)生活中的钢铁制品如废旧铁锅,使用时间长久后若要丢弃,应归为____。
| A.干垃圾 | B.湿垃圾 | C.有毒有害垃圾 | D.可回收垃圾 |
(7)在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成而制得红色砖瓦____。
| A.Fe2O3 | B.Fe3O4 | C.FeO | D.Fe(OH)3 |
(8)要实现Fe转化为Fe2+,可选用足量的____。
| A.浓硫酸 | B.氯气 | C.稀硝酸 | D.稀硫酸 |
(9)下列各组离子在溶液中能大量共存的是____。
A.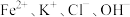 | B.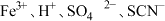 |
C. | D. |
(10)有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是____。
| A.氨水 | B.盐酸 | C.Na2SO4溶液 | D.KSCN溶液 |
Ⅲ.某化学兴趣小组同学设计以下实验探究氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图)

(11)FeSO4可由铁粉还原Fe2(SO4)3制得,反应的离子方程式是:
(12)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。

(13)实验时,先
您最近一年使用:0次
2 . 日本于2023年8月23日将福岛核电站的核污水排入大海,引起了国际上的广泛关注和担忧。其中含有大量的放射性核素如( ),(
),(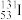 ),(
),( )。等将对人造成一定程度的危害。
)。等将对人造成一定程度的危害。
(1)碘(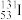 )的中子数是
)的中子数是______ 。在生活中,我们也会摄入含碘(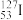 )的食品来补充人体所需的甲状腺激素,(
)的食品来补充人体所需的甲状腺激素,(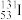 )与(
)与(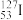 )互为
)互为______ 。
溶液、胶体等是重要的分散系,在生产和生活中有广泛的用途。
高铁酸钾( 极易溶于水)是优良的多功能水处理剂,原理如下图所示。
极易溶于水)是优良的多功能水处理剂,原理如下图所示。

(2)依据物质分类方法, 属于
属于______ (选填),其中铁元素的化合价为______ 价。
A.酸 B.碱 C.盐 D.氧化物
(3)过程①中活细菌表现出______ (填“氧化”或“还原”)性。
(4)根据上述原理分析, 作水处理剂时,所起的作用是
作水处理剂时,所起的作用是______ 和净水剂。
(5)过程③体现了 胶体的净水作用,简述其净水的原理
胶体的净水作用,简述其净水的原理______ 。
(6) 胶体区别于
胶体区别于 溶液最本质的特征是______。(选填)
溶液最本质的特征是______。(选填)
“可燃冰”是由甲烷和水在高压(30000kPa以上)、低温(0~10℃)条件下形成的类冰状白色固体燃料,“可燃冰”平均组成可表示为 。
。
(7)“可燃冰”的摩尔质量为______ 。
(8)若m克CH₄含n个原子,则阿伏加德罗常数可表示为______ 。
(9)若获得11200立方米的纯净 (标况时),甲烷质量为
(标况时),甲烷质量为______ kg,其中含氢原子个数为______ 。
(10)在100kPa、127℃条件下,比较1mol 和1mol
和1mol 气体体积相对大小
气体体积相对大小______ 。(选填)
A.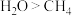 B.
B. C.
C.
 ),(
),(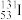 ),(
),( )。等将对人造成一定程度的危害。
)。等将对人造成一定程度的危害。(1)碘(
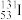 )的中子数是
)的中子数是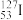 )的食品来补充人体所需的甲状腺激素,(
)的食品来补充人体所需的甲状腺激素,(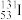 )与(
)与(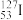 )互为
)互为溶液、胶体等是重要的分散系,在生产和生活中有广泛的用途。
高铁酸钾(
 极易溶于水)是优良的多功能水处理剂,原理如下图所示。
极易溶于水)是优良的多功能水处理剂,原理如下图所示。
(2)依据物质分类方法,
 属于
属于A.酸 B.碱 C.盐 D.氧化物
(3)过程①中活细菌表现出
(4)根据上述原理分析,
 作水处理剂时,所起的作用是
作水处理剂时,所起的作用是(5)过程③体现了
 胶体的净水作用,简述其净水的原理
胶体的净水作用,简述其净水的原理(6)
 胶体区别于
胶体区别于 溶液最本质的特征是______。(选填)
溶液最本质的特征是______。(选填)A. 胶体粒子的直径在1~100nm之间 胶体粒子的直径在1~100nm之间 |
B. 胶体具有丁达尔效应 胶体具有丁达尔效应 |
C. 胶体是均一的分散系 胶体是均一的分散系 |
D. 胶体的分散质粒子能透过半透膜 胶体的分散质粒子能透过半透膜 |
“可燃冰”是由甲烷和水在高压(30000kPa以上)、低温(0~10℃)条件下形成的类冰状白色固体燃料,“可燃冰”平均组成可表示为
 。
。(7)“可燃冰”的摩尔质量为
(8)若m克CH₄含n个原子,则阿伏加德罗常数可表示为
(9)若获得11200立方米的纯净
 (标况时),甲烷质量为
(标况时),甲烷质量为(10)在100kPa、127℃条件下,比较1mol
 和1mol
和1mol 气体体积相对大小
气体体积相对大小A.
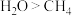 B.
B. C.
C.
您最近一年使用:0次
名校
3 . 前18号元素A、B、C、D、E的原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5;A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外层上的电子数是其电子层数的2倍,A和C可以形成化合物 ;B与D的原子序数之比为
;B与D的原子序数之比为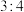 ;E元素原子最外层电子数比次外层电子数少1。请回答:
;E元素原子最外层电子数比次外层电子数少1。请回答:
(1)由A、B两种元素组成的分子有多种,其中一种分子含10个电子,写出其化学式___________ 。
(2)化合物甲由A、B、C、D四种元素组成,既可以与盐酸反应又可以与 溶液反应,且甲为无机正盐,其化学式为
溶液反应,且甲为无机正盐,其化学式为___________ 。
(3)A和D按 形成的化合物的化学式为
形成的化合物的化学式为___________ ,写出由该物质制备D的一种常见单质的反应的化学方程式___________ 。
 ;B与D的原子序数之比为
;B与D的原子序数之比为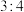 ;E元素原子最外层电子数比次外层电子数少1。请回答:
;E元素原子最外层电子数比次外层电子数少1。请回答:(1)由A、B两种元素组成的分子有多种,其中一种分子含10个电子,写出其化学式
(2)化合物甲由A、B、C、D四种元素组成,既可以与盐酸反应又可以与
 溶液反应,且甲为无机正盐,其化学式为
溶液反应,且甲为无机正盐,其化学式为(3)A和D按
 形成的化合物的化学式为
形成的化合物的化学式为
您最近一年使用:0次
名校
4 . 某同学通过实验“证明鸡蛋壳的主要成分是碳酸钙”,装置示意图如图。
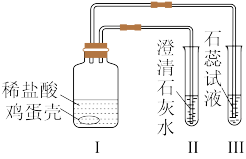
(1)按要求填写碳酸钙的类别属性(如按正离子分类,碳酸钙属于钙盐):按负离子分类,属于_____ ;按聚集状态分类,属于_____ ;按溶解性分类,属于_____ ;按电离程度分类,属于_____ 。
(2)根据碳酸钙的物质类别推知,下列说法或现象不合理的是_____ 。
(3)写出I中发生主要反应的离子方程式_____ ;此反应是否属于氧化还原反应_____ (填“是”或“否”);理由是_____ 。
(4)下列能在澄清石灰水中大量共存的离子组是_____ 。
(5)试用简要的文字说明III中现象产生的原因_____ 。

(1)按要求填写碳酸钙的类别属性(如按正离子分类,碳酸钙属于钙盐):按负离子分类,属于
(2)根据碳酸钙的物质类别推知,下列说法或现象不合理的是
| A.I中的鸡蛋壳发生了分解反应 | B.I中的鸡蛋壳表面产生气泡 |
| C.II中的澄清石灰水变浑浊 | D.III中紫色石蕊试液变浅红 |
(4)下列能在澄清石灰水中大量共存的离子组是
| A.Cu2+、C1- | B.K+、NO | C.H+、SO | D.Na+、CO |
您最近一年使用:0次
2023-01-10更新
|
271次组卷
|
2卷引用:上海市闵行区2022-2023学年高一上学期期末统考化学试题
名校
解题方法
5 . I.分类是研究的方法,如有的物质是电解质、有的是非电解质;有的化学反应是氧化还原反应,有的反应是离子反应。
(1)如图①、②、③三个圈的范围关系,则①、②、③可以是_______。

(2)请用圈画出①氧化还原反应和②离子反应的关系:_______ 。
(3)下列物质发生的反应不属于氧化还原反应的是_______。
II.NaClO是“84”消毒液的有效成分。请回答下列问题。
(4)NaClO中Cl元素的化合价是_______ 。
(5)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,这是因为和空气中的_______ (填物质的化学式)反应生成了具漂白作用的_______ (填物质的化学式)。
(6)若将“84”消毒液与洁厕灵主要成分是盐酸 混合使用,则会产生黄绿色的有毒气体,写出该反应的离子方程式:_______ 。请标出上述反应中电子转移的方向和数目_______ ,该反应中被还原的元素是_______ 。
III.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(7)化工厂可用浓氨水来检验Cl2是否泄漏:3Cl2+8NH3=6NH4Cl+N2,上述反应中当有0.8mol氨参与反应生成0.6mol氯化铵时,下列说法中正确的是_______。
(1)如图①、②、③三个圈的范围关系,则①、②、③可以是_______。

| A.①氧化物 ②纯净物 ③化合物 | B.①盐 ②正盐 ③钠盐 |
| C.①单质 ②电解质 ③化合物 | D.①胶体 ②分散系 ③混合物 |
(3)下列物质发生的反应不属于氧化还原反应的是_______。
| A.Zn+2HCl=ZnCl2+H2↑ | B.Ca(ClO)2+2HCl=CaCl2+2HClO |
| C.MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O | D.3Cl2+6KOH(浓) 5KCl+KClO3+3H2O 5KCl+KClO3+3H2O |
II.NaClO是“84”消毒液的有效成分。请回答下列问题。
(4)NaClO中Cl元素的化合价是
(5)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,这是因为和空气中的
(6)若将“84”消毒液与洁厕灵主要成分是盐酸 混合使用,则会产生黄绿色的有毒气体,写出该反应的离子方程式:
III.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(7)化工厂可用浓氨水来检验Cl2是否泄漏:3Cl2+8NH3=6NH4Cl+N2,上述反应中当有0.8mol氨参与反应生成0.6mol氯化铵时,下列说法中正确的是_______。
| A.生成了2.24升氮气 | B.被氧化的氨气为0.2mol |
| C.反应中转移了4.8mol电子 | D.氯化铵是还原产物 |
您最近一年使用:0次
2022高一·上海·专题练习
6 . 下列是某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题。
(1)通过分析实验一可知,氢氧化钠会吸收空气中的_______ 。

(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起_______ 作用。

(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列物质会产生如图现象:A中溶液显红色,B、C、D中均产生白色沉淀。

①写出D试管中反应的化学方程式_______ 。
②不同的碱溶液中都含有OH-,所以,碱有一些相似的化学性质。上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是_______ (填字母序号)。
(4)冬冬发现工业上使用的氢氧化钠固体标签如图所示,于是对其所含杂质进行了探究。

【提出问题】_______ 。
【提出猜想】猜想Ⅰ:查阅资料可知,工业用氢氧化钠可能含有NaCl。
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是_______ (用简洁的文字表述)。
【进行实验】
(1)通过分析实验一可知,氢氧化钠会吸收空气中的

(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起

(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列物质会产生如图现象:A中溶液显红色,B、C、D中均产生白色沉淀。

①写出D试管中反应的化学方程式
②不同的碱溶液中都含有OH-,所以,碱有一些相似的化学性质。上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是
(4)冬冬发现工业上使用的氢氧化钠固体标签如图所示,于是对其所含杂质进行了探究。

【提出问题】
【提出猜想】猜想Ⅰ:查阅资料可知,工业用氢氧化钠可能含有NaCl。
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是
【进行实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量固体样品于试管中,加水溶解 | 固体全部溶解 | |
| ②向①所得溶液中滴加过量的 | 一开始无明显变化,一会儿后产生能使澄清石灰水变浑浊的气体 | 样品中含有Na2CO3 |
| ③向②所得溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有NaCl。反应的化学方程式为 |
您最近一年使用:0次
2022高一·上海·专题练习
解题方法
7 . 为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。
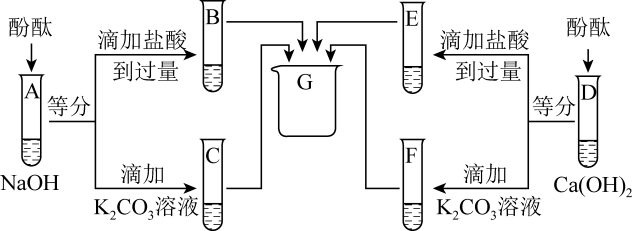
(1)A、D中酚酞均变_______ 色,说明两种溶液都呈碱性。
(2)B中溶液的pH_______ 7(选填“>”、“<”或“=”)。写出氢氧化钠与盐酸反应的化学方程式_______ 。
(3)F中沉淀的化学式是_______ 。
(4)四支试管内的物质在G中混合后得到无色溶液,其中一定含有的溶质是_______ ,可能含有的溶质是_______ 。

(1)A、D中酚酞均变
(2)B中溶液的pH
(3)F中沉淀的化学式是
(4)四支试管内的物质在G中混合后得到无色溶液,其中一定含有的溶质是
您最近一年使用:0次
2022高一·上海·专题练习
解题方法
8 . 化学实验小组欲探究盐酸、氢氧化钙的化学性质,进行如下实验。

(1)实验中观察到有气泡出现的是_______ ,有沉淀生成的是_______ (选填试管编号)。
(2)B中的实验现象是_______ 。
(3)写出实验中无明显现象的试管中发生的化学方程式_______ 。
(4)实验后某试管中为红色溶液,当向其中加入过量的_______ 后,溶液变为蓝色,由此推断该试管是_______ (填字母序号)。

(1)实验中观察到有气泡出现的是
(2)B中的实验现象是
(3)写出实验中无明显现象的试管中发生的化学方程式
(4)实验后某试管中为红色溶液,当向其中加入过量的
您最近一年使用:0次
名校
解题方法
9 . 随着新能源汽车销量逐年攀升,动力电池的制备和回收利用技术至关重要。一种锂电池的正极材料——磷酸铁锂(LiFePO4)的制备方法框图所示。

回答下列问题:
(1)LiFePO4中铁元素的化合价为___________ 。氧化铁红属于氧化物,其化学式为___________ 。上述属于酸式盐的化学式为___________ 。
(2)将Li2CO3、磷酸铁与足量炭黑混合高温灼烧制备LiFePO4,写出化学反应方程式。___________ 。炭黑的另一个作用是___________ 。
含LiFePO4的废旧电池回收制备Li2CO3的流程图如下:

(3)浸出过程中温度不宜高于40℃,原因是___________ 。
(4)操作a的名称为___________ ,需使用玻璃仪器有___________ 。
(5)“沉锂”步骤的反应原理为___________ 。已知在20℃时,S(Li2CO3)=1.3g/100g水。S(Na2CO3)=20g/100g水,简述上述反应发生的原因___________ 。
(6)欲证明Li2CO3产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)___________ 。

回答下列问题:
(1)LiFePO4中铁元素的化合价为
(2)将Li2CO3、磷酸铁与足量炭黑混合高温灼烧制备LiFePO4,写出化学反应方程式。
含LiFePO4的废旧电池回收制备Li2CO3的流程图如下:

(3)浸出过程中温度不宜高于40℃,原因是
(4)操作a的名称为
(5)“沉锂”步骤的反应原理为
(6)欲证明Li2CO3产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)
您最近一年使用:0次
名校
10 . 有A、B、C、D、E五种元素,它们的核电荷数依次增大,且均小于20.A为非金属元素,A和D的最外层电子数相同。B元素的单质是空气的主要成分,C原子的最外层电子数是次外层的3倍。D原子的质子数等于B、C原子最外层电子数之和,E元素的氧化物是玻璃的主要成分。回答下列问题:
(1)B原子的结构示意图为___________ ,E原子的电子式___________ 。
(2)D2C是由两种10电子微粒构成的,分别写出这两种微粒的电子式:___________ 、___________ 。
(3)写出A、C、D形成的化合物与E的氧化物反应的化学方程式:___________
(4)已知E的氧化物和氢氟酸(HF)可以反应生成EF4和H2O,E的氧化物属于___________(选填编号)
(1)B原子的结构示意图为
(2)D2C是由两种10电子微粒构成的,分别写出这两种微粒的电子式:
(3)写出A、C、D形成的化合物与E的氧化物反应的化学方程式:
(4)已知E的氧化物和氢氟酸(HF)可以反应生成EF4和H2O,E的氧化物属于___________(选填编号)
| A.酸性氧化物 | B.碱性氧化物 | C.两性氧化物 | D.不成盐氧化物 |
您最近一年使用:0次



