名校
1 . 下列化学用语表示正确的是
A. 的结构式: 的结构式: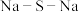 | B. 的电子式: 的电子式: |
C.中子数为6的B原子: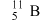 | D.胆矾的化学式: |
您最近一年使用:0次
23-24高一下·吉林·开学考试
名校
解题方法
2 . 1828年,德国化学家维勒在制备无机盐氰酸铵( )时得到尿素
)时得到尿素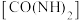 。尿素的人工合成,揭开了人工合成有机物的序幕。完成下列填空:
。尿素的人工合成,揭开了人工合成有机物的序幕。完成下列填空:
(1)将上述元素按原子半径由小到大的顺序排列________ 。(用元素符号表示)
(2)已知氰酸分子内含有叁键,且所有原子最外层均已达到稳定结构,试写出其结构式________ 。
(3) 性质与
性质与 相似,也可与硫酸反应生成
相似,也可与硫酸反应生成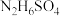 ,则
,则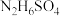 中存在的作用力为
中存在的作用力为________ ,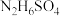 与强碱溶液反应的离子方程式为
与强碱溶液反应的离子方程式为________
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( )。
)。
①写出反应的化学方程式,并用单线桥标出电子转移方向与数目________ 。
②还原产物是________ ,若反应中有 个电子发生转移,参与反应的氨的质量为
个电子发生转移,参与反应的氨的质量为________ g。
 )时得到尿素
)时得到尿素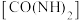 。尿素的人工合成,揭开了人工合成有机物的序幕。完成下列填空:
。尿素的人工合成,揭开了人工合成有机物的序幕。完成下列填空:(1)将上述元素按原子半径由小到大的顺序排列
(2)已知氰酸分子内含有叁键,且所有原子最外层均已达到稳定结构,试写出其结构式
(3)
 性质与
性质与 相似,也可与硫酸反应生成
相似,也可与硫酸反应生成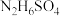 ,则
,则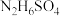 中存在的作用力为
中存在的作用力为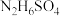 与强碱溶液反应的离子方程式为
与强碱溶液反应的离子方程式为(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 )。
)。①写出反应的化学方程式,并用单线桥标出电子转移方向与数目
②还原产物是
 个电子发生转移,参与反应的氨的质量为
个电子发生转移,参与反应的氨的质量为
您最近一年使用:0次
名校
解题方法
3 . 下列有关化学用语的表示方法中错误的是
A.次氯酸的电子式: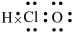 | B.S2-的结构示意图: |
C.中子数为10的氧原子符号: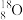 | D.CO2分子的结构式:O=C=O |
您最近一年使用:0次
2024-03-08更新
|
230次组卷
|
6卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一下学期4月月考化学试题
名校
4 . 下列描述正确的是
A.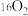 与 与 是同素异形体 是同素异形体 | B. 的分子结构模型是 的分子结构模型是 |
C.氚的原子结构模型是 | D.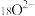 的离子结构示意图是 的离子结构示意图是 |
您最近一年使用:0次
2024-03-04更新
|
98次组卷
|
3卷引用:吉林省长春市东北师范大学附属中学2023-2024学年高一上学期期末化学试题
名校
解题方法
5 . 短周期主族元素X、Y、Z、M、N、Q的原子序数依次增大,其中X的一种原子无中子,Y、N同主族,Y的最外层电子数是周期数的3倍,Z与Y的核电荷数之差为3,M是地壳中含量最多的金属。回答下列问题:
(1)N在元素周期表中的位置是___________ ,Y的离子结构示意图为___________ 。
(2)Y、M、N三种元素所形成的简单离子,半径由大到小的顺序是___________ (填化学式,下同)。N、Q的简单氢化物热稳定性较差的是___________ 。
(3)X、Y、Z形成的化合物中化学键类型为___________ 。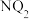 的电子式为
的电子式为___________ 。
(4)实验室检验Z简单离子的方法是___________ 。
(5) M最高价氧化物对应的水化物分别与Z、Q最高价氧化物对应的水化物反应的离子方程式为___________ 、___________ 。
(1)N在元素周期表中的位置是
(2)Y、M、N三种元素所形成的简单离子,半径由大到小的顺序是
(3)X、Y、Z形成的化合物中化学键类型为
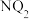 的电子式为
的电子式为(4)实验室检验Z简单离子的方法是
(5) M最高价氧化物对应的水化物分别与Z、Q最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
2024-03-02更新
|
140次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一下学期开学化学试题
解题方法
6 . 下列化学用语使用正确的是
A. 和 和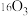 互为同位素 互为同位素 |
B.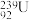 中质子数和中子数相差147 中质子数和中子数相差147 |
C.用电子式表示 的形成过程: 的形成过程: |
D. 的结构式: 的结构式: |
您最近一年使用:0次
名校
解题方法
7 . 下列描述正确的是
A.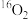 与 与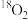 是同素异形体 是同素异形体 |
B. 的分子结构模型是 的分子结构模型是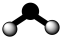 |
C.氚的原子结构模型是 |
D.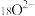 的离子结构示意图是 的离子结构示意图是 |
您最近一年使用:0次
8 . 家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,请回答下列问题。
(1)标签中涉及到的金属元素有___________  ,非金属元素有
,非金属元素有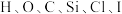 ;
; 在元素周期表中的位置是
在元素周期表中的位置是___________ , 的结构示意图为
的结构示意图为___________ 。
(2)写出由 两种元素组成的常见温室气体的电子式
两种元素组成的常见温室气体的电子式___________ 。
(3)比较下列性质,用“>”、“=”或“<”填空。
①酸性:
___________ 
②还原性:
___________ 
③离子半径: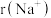
___________ 
(4)用以下对比实验探究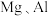 的金属性强弱以及
的金属性强弱以及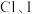 的非金属性强弱。
的非金属性强弱。
| 铝镁咀嚼片 【药品名】铝镁咀嚼片 【成分】氢氧化镁、氢氧化铝、二甲基硅油 【适应症】胃酸过多引起的胃痛、烧心等胃胀气的治疗 | 食用盐 【配料表】精制盐、碘酸钾 【碘含量(以I计)】21mg/kg~39mg/kg 【保质期】36个月 |
 ,非金属元素有
,非金属元素有 ;
; 在元素周期表中的位置是
在元素周期表中的位置是 的结构示意图为
的结构示意图为(2)写出由
 两种元素组成的常见温室气体的电子式
两种元素组成的常见温室气体的电子式(3)比较下列性质,用“>”、“=”或“<”填空。
①酸性:


②还原性:


③离子半径:

(4)用以下对比实验探究
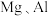 的金属性强弱以及
的金属性强弱以及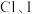 的非金属性强弱。
的非金属性强弱。| 比较Mg、Al金属性强弱 | 比较Cl、I非金属性强弱 |
选择的试剂: 溶液、 溶液、 溶液、氨水、 溶液、氨水、 溶液 溶液 | 选择的试剂:新制氯水、 溶液 溶液 |
操作:向两支试管中分别加入少许 溶液和 溶液和 溶液,然后滴加氨水,直到不再产生白色沉淀 溶液,然后滴加氨水,直到不再产生白色沉淀 和白色沉淀 和白色沉淀 为止,再向两支试管中分别加入 为止,再向两支试管中分别加入 溶液,边加边振荡,观察现象。 溶液,边加边振荡,观察现象。 | 操作:向盛有 溶液的试管中加入 溶液的试管中加入 新制氯水,振荡 新制氯水,振荡 |
| 现象: | 现象:溶液由无色变为棕黄色 化学方程式: |
结论:金属性 强于 强于 | 结论:非金属性Cl强于I |
您最近一年使用:0次
名校
9 . 结合元素周期表,回答下列问题:
(1)①、③、⑨按照原子个数比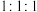 构成化合物的结构式
构成化合物的结构式___________ 。
(2)写出含有③、⑤元素且既具有离子键又具有非极性共价键化合物的电子式___________ 。
(3)①②③⑤形成化合物在水溶液中的电离方程式___________ 。
(4)下列事实能用元素周期律解释并正确的是___________ (填字母序号)。
a.对应阴离子还原性由强到弱的顺序为⑧>⑨>④
b.⑨的气态氢化物的稳定性大于④的氢化物
c.原子序数为35的元素最高价氧化物的水化的酸性比⑨最高价氧化物的水化的酸性强
d.③的简单氢化物的沸点高于⑧的氢化物
e.原子半径由小到大的顺序为③<⑧<⑥<⑤
(5)②和⑦按照原子个数比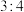 构成的固体化合物,易与水反应生成可燃性气体和白色沉淀。在相同条件下,此气体密度是
构成的固体化合物,易与水反应生成可燃性气体和白色沉淀。在相同条件下,此气体密度是 密度的8倍。化合物与水反应的化学方程式为
密度的8倍。化合物与水反应的化学方程式为___________ 。
(6)W是第Ⅷ族中原子序数最小的元素。W的单质可用于处理酸性废水中的 ,使其转换为
,使其转换为 ,同时生成有磁性的W的氧化物X,再进行后续处理。上述反应的离子方程式为
,同时生成有磁性的W的氧化物X,再进行后续处理。上述反应的离子方程式为___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
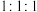 构成化合物的结构式
构成化合物的结构式(2)写出含有③、⑤元素且既具有离子键又具有非极性共价键化合物的电子式
(3)①②③⑤形成化合物在水溶液中的电离方程式
(4)下列事实能用元素周期律解释并正确的是
a.对应阴离子还原性由强到弱的顺序为⑧>⑨>④
b.⑨的气态氢化物的稳定性大于④的氢化物
c.原子序数为35的元素最高价氧化物的水化的酸性比⑨最高价氧化物的水化的酸性强
d.③的简单氢化物的沸点高于⑧的氢化物
e.原子半径由小到大的顺序为③<⑧<⑥<⑤
(5)②和⑦按照原子个数比
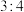 构成的固体化合物,易与水反应生成可燃性气体和白色沉淀。在相同条件下,此气体密度是
构成的固体化合物,易与水反应生成可燃性气体和白色沉淀。在相同条件下,此气体密度是 密度的8倍。化合物与水反应的化学方程式为
密度的8倍。化合物与水反应的化学方程式为(6)W是第Ⅷ族中原子序数最小的元素。W的单质可用于处理酸性废水中的
 ,使其转换为
,使其转换为 ,同时生成有磁性的W的氧化物X,再进行后续处理。上述反应的离子方程式为
,同时生成有磁性的W的氧化物X,再进行后续处理。上述反应的离子方程式为
您最近一年使用:0次
2024-02-08更新
|
131次组卷
|
2卷引用:吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题
名校
10 . 下表为元素周期表的一部分。请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:

(1)画出表中形成化合物种类最多的元素的原子结构示意图___________ ;考古工作者利用该元素的一种核素测定一些文物的年代,这种核素的原子符号为___________ 。写出该元素与原子半径最小的原子形成的10电子分子的结构式___________ ,上述分子的空间结构呈___________ 形。
(2)写出①③两种元素形成的18电子微粒的电子式___________ 。
(3)③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为___________ (填离子符号)④⑤⑥⑧形成的简单离子半径由大到小的顺序为___________ (填离子符号),用电子式表示⑤和⑧形成化合物的过程___________ 。
(4)有两种化合物A和B都由①④⑤⑧四种元素组成,若A与B在水溶液中能发生离子反应、则该反应的离子方程式为___________ 。

(1)画出表中形成化合物种类最多的元素的原子结构示意图
(2)写出①③两种元素形成的18电子微粒的电子式
(3)③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)有两种化合物A和B都由①④⑤⑧四种元素组成,若A与B在水溶液中能发生离子反应、则该反应的离子方程式为
您最近一年使用:0次



