安徽省滁州市定远县民族中学2021-2022学年高二上学期9月质量检测化学试题
安徽
高二
阶段练习
2021-09-23
276次
整体难度:
容易
考查范围:
认识化学科学、化学实验基础、化学与STSE、常见无机物及其应用、物质结构与性质、化学反应原理、有机化学基础
一、单选题 添加题型下试题
| A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 |
| B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 |
| C.“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属于化学变化 |
| D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应 |
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 碘酒 | 食盐水 | 氯化铜 | 碳酸钠 |
| A.A | B.B | C.C | D.D |
【知识点】 无机物质的分类 电解质与非电解质 非电解质、电解质物质类别判断解读
| A.24gMg变为Mg2+时失去的电子数为2NA |
| B.46gNO2和N2O4混合气体中含有原子总数为2.5NA |
| C.23gNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去1.5NA个电子 |
| D.反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,生成3mol氯气时转移6NA个电子 |
【知识点】 阿伏加德罗常数的应用解读 钠与氧气等非金属的反应解读
A.H+、Na+、 、 、 | B.Na+、 、Al3+、Cl- 、Al3+、Cl- |
C.K+、Na+、Cl-、 | D.K+、Cl-、Ba2+、 |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
 +H2C2O4+H+→CO2↑+Mn2++(未配平)。下列叙述
+H2C2O4+H+→CO2↑+Mn2++(未配平)。下列叙述| A.发生氧化反应的是H2C2O4 | B.每消耗6个H+,转移5个电子 |
| C.还原性:Mn2+<H2C2O4 | D.离子方程式右侧方框内的产物是H2O |
A.次氯酸的电子式: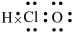 | B.S2-的结构示意图: |
C.中子数为10的氧原子符号: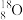 | D.CO2分子的结构式:O=C=O |
①碳酸氢钙溶液与过量烧碱溶液混合:

②碳酸镁与稀硫酸:
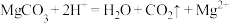
③醋酸与大理石:
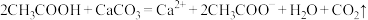
④向
 溶液中逐滴加入
溶液中逐滴加入 溶液至
溶液至 刚好沉淀完全:
刚好沉淀完全:
⑤
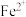 与
与 在酸性溶液中的反应:
在酸性溶液中的反应:
| A.①②③④⑤ | B.②③④ | C.②③④⑤ | D.①③④ |
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
| A | FeCl3(aq) | Fe2+ | 通Cl2 |
| B | AlCl3(aq) | Cu2+ | Al粉 |
| C | NaHCO3(aq) | Na2CO3 | CO2气体 |
| D | FeCl3(aq) | Cu2+ | Fe粉 |
| A.A | B.B | C.C | D.D |
【知识点】 物质的分离、提纯 物质分离、提纯的常见化学方法解读
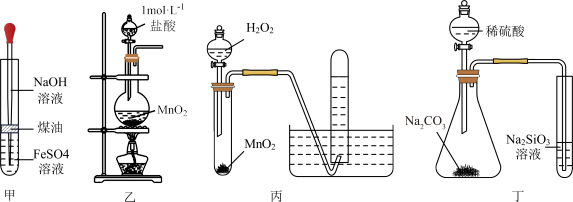
| A.用图甲制备Fe(OH)2 | B.用图乙制备少量Cl2 |
| C.用图丙制备并收集O2 | D.用图丁比较S、C、Si的非金属性强弱 |
| A.该转化过程的实质为NOx被H2还原 |
| B.过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+ |
| C.处理过程中,混合溶液中Ce3+和Ce4+总数减少 |
| D.x=1时,过程II中氧化剂与还原剂的物质的量之比为2:1 |
【知识点】 氧化还原反应有关计算 氧化还原反应在生活、生产中的应用解读
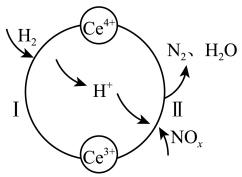
| A.O2在电极b上发生氧化反应 |
| B.溶液中OH-向电极b移动 |
| C.反应消耗的NH3与O2的物质的量之比为4:3 |
| D.正极的电极反应式为2NH3-6e-+6OH-=N2+6H2O |
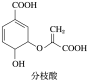
| A.1mol分枝酸可以和3molH2发生加成反应 |
| B.该有机物可发生取代反应、加成反应和氧化反应 |
| C.该有机物有5种官能团 |
| D.可使溴的四氯化碳、酸性高锰酸钾溶液褪色,褪色原理不同 |
| A.已知:正丁烷(g)=异丁烷(g)△H<0,则正丁烷比异丁烷稳定 |
| B.已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1478.8k·mol-1,则C2H4的燃烧热△H=-1478.8kJ·mol-1 |
| C.已知:H+(aq)+OH-(aq)==H2O(1)△H=-57.3kJ·mol-1,但稀Ba(OH)2(aq)和稀H2SO4(aq)完全反应生成1molH2O(1)时,放出的热量大于57.3kJ |
| D.已知:S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g)△H2,则△H1>△H2 |
【知识点】 热化学方程式 中和热 化学能与物质稳定性之间的关系解读
 2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )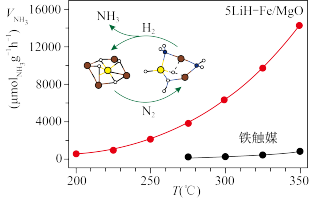
| A.过程中有极性键形成 |
| B.复合催化剂降低了反应的活化能 |
| C.复合催化剂能降低合成氨反应的焓变 |
| D.350℃,催化效率:5LiH-Fe/MgO>铁触媒 |
【知识点】 化学反应中能量变化的原因 催化剂对化学反应速率的影响解读
| A.加入少量稀NaOH溶液 | B.加入少量NaHCO3固体 |
| C.加入少量NaHSO4固体 | D.加入少量NaCl溶液 |
【知识点】 影响化学反应速率的因素 浓度对化学反应速率的影响解读
二、多选题 添加题型下试题
| A.混合气体的密度保持不变 |
| B.SO2的转化率保持不变 |
| C.混合气体的平均相对分子质量保持不变 |
| D.O2的消耗速率和SO3的消耗速率相等 |
【知识点】 化学平衡状态的判断方法解读
三、解答题 添加题型下试题
(1)元素F在元素周期表中的位置是
(2)C、D、E三种元素原子半径由小到大的顺序是
(3)C和D形成电子总数为38的化合物中化学键类型有
(4)写出D的最高价氧化物对应的水化物的电子式
(5)E、F两种元素形成的氢化物中还原性较强的是
【知识点】 元素周期律、元素周期表的推断
四、填空题 添加题型下试题

(1)图中各装置中电极上发生还原反应的粒子分别是(填离子或分子的化学式):甲
(2)丙装置中负极反应式为
(3)电池的放电过程中,甲装置中溶液质量
(4)当甲装置导线中转移0.3mol电子时,正极生成气体
【知识点】 原电池原理的应用 原电池电极反应式书写解读 原电池有关计算解读
五、解答题 添加题型下试题
Ⅰ.回流。如图所示,在100mL圆底烧瓶中加入10g小颗粒状的生石灰和少量氢氧化钠,慢慢注入50mL工业乙醇,回流1h。
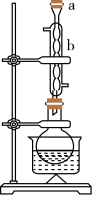
Ⅱ.蒸馏。如图所示,回流完毕,待烧瓶冷却后在烧瓶中加入几粒沸石,改为蒸馏装置,收集78℃时的馏分,即为无水乙醇。(用△表示酒精灯)。

试回答下列问题:
(1)装置b的名称是
(2)简述向烧瓶中加入生石灰的方法
(3)加入
 固体是为了除去工业乙醇中少量的醛,发生的反应为
固体是为了除去工业乙醇中少量的醛,发生的反应为 ,该反应的反应类型为
,该反应的反应类型为(4)蒸馏时,待温度计示数为78℃左右时,尾接管中出现液滴,弃去开始流出的液体,原因是
(5)有同学建议改蒸馏为过滤,请回答过滤法不妥的原因是
六、填空题 添加题型下试题
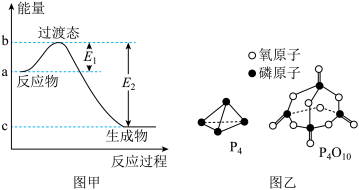
(1)图甲是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂。反应速率加快,E1的变化是
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
(3)下表所示是部分化学键的键能参数。
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |
试卷分析
导出试卷题型(共 20题)
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 胶体的性质和应用 氧化还原反应基本概念 萃取和分液 化学在工业中的应用 | |
| 2 | 0.85 | 无机物质的分类 电解质与非电解质 非电解质、电解质物质类别判断 | |
| 3 | 0.85 | 阿伏加德罗常数的应用 钠与氧气等非金属的反应 | |
| 4 | 0.65 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 5 | 0.65 | 氧化还原反应有关计算 氧化还原反应方程式的书写与配平 氧化还原反应在生活、生产中的应用 电子转移计算 | |
| 6 | 0.65 | 原子结构示意图、离子结构示意图 结构式、结构简式、比例模型、球棍模型、最简式 电子式 元素、核素、同位素 | |
| 7 | 0.65 | 离子方程式的正误判断 碳酸氢钠与碱反应 Fe2+的还原性 | |
| 8 | 0.65 | 物质的分离、提纯 物质分离、提纯的常见化学方法 | |
| 9 | 0.65 | 氢氧化亚铁的制备 元素金属性、非金属性强弱探究实验 常见气体的制备与收集 化学实验方案的设计与评价 | |
| 10 | 0.65 | 氧化还原反应有关计算 氧化还原反应在生活、生产中的应用 | |
| 11 | 0.85 | 原电池正负极判断 原电池电极反应式书写 新型电池 原电池有关计算 | |
| 12 | 0.65 | 常见官能团名称、组成及结构 含碳碳双键物质的性质的推断 羧酸的酸性 多官能团有机物的结构与性质 | |
| 13 | 0.85 | 热化学方程式 中和热 化学能与物质稳定性之间的关系 | |
| 14 | 0.85 | 化学反应中能量变化的原因 催化剂对化学反应速率的影响 | |
| 15 | 0.85 | 影响化学反应速率的因素 浓度对化学反应速率的影响 | |
| 二、多选题 | |||
| 16 | 0.65 | 化学平衡状态的判断方法 | |
| 三、解答题 | |||
| 17 | 0.65 | 元素周期律、元素周期表的推断 | 无机推断题 |
| 19 | 0.65 | 乙醇 乙醛 常见有机物的制备 | 实验探究题 |
| 四、填空题 | |||
| 18 | 0.65 | 原电池原理的应用 原电池电极反应式书写 原电池有关计算 | |
| 20 | 0.85 | 化学反应热的计算 盖斯定律的应用 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |



