21-22高一上·浙江·阶段练习
1 . 化学用语是学习化学的基本工具,是高中化学的重要内容,请根据要求用合适的化学用语填空:
(1)从分子结构上来看,氮与碳有很多对应的物质(如CH4和NH3对应),请找出下列含碳化合物对应的含氮物质(填写化学式):H2CO3_____ ;C2H2_____ 。
(2)已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2价或+4价,那么Pb3O4也可以写成_____ 或_____ 。(填写化学式)
(3)在法庭医学分析上常用马氏砷法来证明受害者是否为砒霜(As2O3)中毒。用锌和盐酸与试样混合在一起,若试样中有砒霜,就会发生反应生成砷化氢(AsH3)、锌盐溶液。写出该反应的化学方程式_____ 。
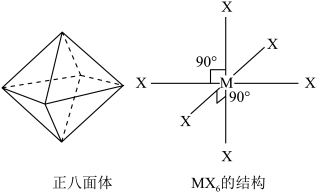
(4)某化合物MX6分子呈正八面体形式(如图所示)。由于六个X原子与M的连接完全对称,因此将任意一个X用Y原子替换均只能得到一种结构的MX5Y。按此思路,若将其中任意两个X原子用Y原子替换,请画出化学式为MX4Y2的各种结构_____ 。
(1)从分子结构上来看,氮与碳有很多对应的物质(如CH4和NH3对应),请找出下列含碳化合物对应的含氮物质(填写化学式):H2CO3
(2)已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2价或+4价,那么Pb3O4也可以写成
(3)在法庭医学分析上常用马氏砷法来证明受害者是否为砒霜(As2O3)中毒。用锌和盐酸与试样混合在一起,若试样中有砒霜,就会发生反应生成砷化氢(AsH3)、锌盐溶液。写出该反应的化学方程式
(4)某化合物MX6分子呈正八面体形式(如图所示)。由于六个X原子与M的连接完全对称,因此将任意一个X用Y原子替换均只能得到一种结构的MX5Y。按此思路,若将其中任意两个X原子用Y原子替换,请画出化学式为MX4Y2的各种结构

您最近一年使用:0次
2 . 工业上利用氧化铝基废催化剂(主要成分为Al2O3,少量Pd)回收Al2(SO4)3及Pd 流程如图:

说明:上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。
(1)焙烧时产生气体X的结构式为________ 。
(2)水浸分离中,滤渣Pd的颗粒比较大,一般可以采用的分离方法是_________ (填字母)
A.过滤 B.抽滤 C.倾析 D.渗析
(3)写出酸浸时发生反应的离子方式______ (已知氯钯酸为弱酸)
(4)某同学在实验室用如下图所示装置完成Pd的热还原实验,并计算滤渣中 (NH4)2PdCl6的百分含量(滤渣中的杂质不参与热还原反应)。

①写出热还原法过程中发生反应的化学方程式________ 。
②i.将石英玻璃管中(带开关;K1和K2)(设为装置A )称重,记为mi g。将滤渣 [(NH4)2PdCl6]装入石英玻璃管中,再次将装置A称重,记为m2 g。
ii.连接好装置后,按d→ → →b→ →e(填标号)顺序进行实验。_______
a.关闭K1和K2 b.熄灭酒精灯 c.点燃酒精灯,加热
d.打开K1和K2 e.称量A f.缓缓通入H2 g.冷却至室温
iii.重复上述操作步骤,直至A恒重,记为m3g。
③根据实验记录,计算滤渣中(NH4)2PdCl6的百分含量__________ [列式表示,其中(NH4)2PdCl6相对分子质量为355]。
④实验结束时,发现硬质试管右端有少量白色固体,可能是____ (填化学式),这种情况导致实验结果_________ (填“偏高”、“偏低”、“无影响”)

说明:上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。
(1)焙烧时产生气体X的结构式为
(2)水浸分离中,滤渣Pd的颗粒比较大,一般可以采用的分离方法是
A.过滤 B.抽滤 C.倾析 D.渗析
(3)写出酸浸时发生反应的离子方式
(4)某同学在实验室用如下图所示装置完成Pd的热还原实验,并计算滤渣中 (NH4)2PdCl6的百分含量(滤渣中的杂质不参与热还原反应)。

①写出热还原法过程中发生反应的化学方程式
②i.将石英玻璃管中(带开关;K1和K2)(设为装置A )称重,记为mi g。将滤渣 [(NH4)2PdCl6]装入石英玻璃管中,再次将装置A称重,记为m2 g。
ii.连接好装置后,按d→ → →b→ →e(填标号)顺序进行实验。
a.关闭K1和K2 b.熄灭酒精灯 c.点燃酒精灯,加热
d.打开K1和K2 e.称量A f.缓缓通入H2 g.冷却至室温
iii.重复上述操作步骤,直至A恒重,记为m3g。
③根据实验记录,计算滤渣中(NH4)2PdCl6的百分含量
④实验结束时,发现硬质试管右端有少量白色固体,可能是
您最近一年使用:0次
2020-01-01更新
|
503次组卷
|
2卷引用:辽宁省实验中学2022届高三第一次阶段性考试化学试题
名校
3 . KMnO4是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿(主要成分MnO2,还有Fe2O3、Al2O3、SiO2等)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得KMnO4(反应条件已经省略)。
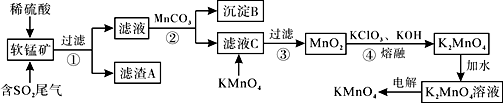
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)K2MnO4中Mn的化合价为___________ 。
(2)滤渣A的成分是_________ ,析出沉淀B时,首先析出的物质是_________ 。
(3)步骤2中加入MnCO3的作用为_______________ 。
(4)滤液C中加入KMnO4时发生反应的离子方程式是_________________ 。
(5)步骤4中反应的化学方程式是_______________ 。
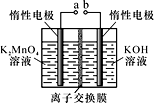
(6)电解制备KMnO4的装置如图所示。b与电源的______ 极相连,电解液中最好选择_______ 离子交换膜(填“阳”或“阴”)。电解时,阳极的电极反应式为_________ 。

已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)K2MnO4中Mn的化合价为
(2)滤渣A的成分是
(3)步骤2中加入MnCO3的作用为
(4)滤液C中加入KMnO4时发生反应的离子方程式是
(5)步骤4中反应的化学方程式是
(6)电解制备KMnO4的装置如图所示。b与电源的

您最近一年使用:0次
2019-01-25更新
|
1214次组卷
|
2卷引用:安徽师范大学附属中学2021-2022学年高三上学期11月考试化学试题
10-11高一下·浙江台州·期末
名校
4 . 下列化学用语或模型正确的是
A.氯化氢的电子式: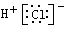 | B.N2的结构式:N≡N |
C.硫离子结构示意图: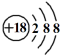 | D.CH4分子的球棍模型: |
您最近一年使用:0次
2016-12-09更新
|
607次组卷
|
8卷引用:浙江省丽水市2020-2021学年高二上学期期末质量监控化学试题
浙江省丽水市2020-2021学年高二上学期期末质量监控化学试题(已下线)【浙江新东方】双师223高一下(已下线)2010~2011学年浙江省台州市高一下学期期末考试化学(已下线)2011-2012年浙江永嘉县普高联合体高一下学期期中联考化学试卷【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高一下学期期中联考化学试题河北省辛集中学2020届高三上学期期中考试化学试题(已下线)2022年浙江1月高考真题变式题(1-10)浙江省龙泉浙大中学2022-2023学年高二上学期12月教学质量检测化学试题



