解题方法
1 . 如表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
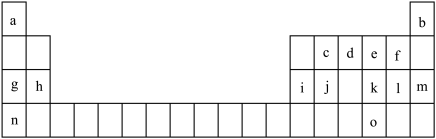
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为______ 。(填元素符号)
(2)画出d元素原子的结构示意图_______ ,其气态氢化物能与其最高价氧化物对应水化物反应,反应生成的物质为_______ 。(填化学式)
(3)下列描述正确且能说明e元素的非金属性比o元素强的是_______ 。
(4)f,l,n的简单离子半径由大到小的顺序是_______ 。(用对应的离子符号表示)
(5)在盛有水的小烧杯中加入元素g的单质,待反应完成后,向上述反应后的溶液中再加入元素i的单质,则元素i发生反应的化学方程式为_______ 。
(6)用电子式表示g与l形成的化合物的过程______ 。

请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为
(2)画出d元素原子的结构示意图
(3)下列描述正确且能说明e元素的非金属性比o元素强的是
| A.e元素的单质熔点比o元素单质的低 |
| B.e元素的单质与氢气化合比o元素的单质更容易 |
| C.e元素最高价氧化物对应水化物的酸性比o的强 |
| D.e元素形成的氢化物比o元素形成的氢化物更稳定 |
(5)在盛有水的小烧杯中加入元素g的单质,待反应完成后,向上述反应后的溶液中再加入元素i的单质,则元素i发生反应的化学方程式为
(6)用电子式表示g与l形成的化合物的过程
您最近一年使用:0次
解题方法
2 . 有A、B、C、D、E五种短周期主族元素,原子序数依次增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D与B同主族且D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
(1)A元素的最高价氧化物的电子式_____ 。
(2)D元素在周期表的位置是_____ ,其简单阴离子的结构示意图为_____ 。B、C、D、E的简单离子半径由小到大的顺序为_____ (用化学式表示)。
(3)①下列表述能证明D非金属性比E弱这一事实的有_____ (填序号)。
A.常温下D的单质和E的单质状态不同
B.E的氢化物比D的氢化物稳定
C.一定条件下D和E的单质都能与钠反应
D.D的最高价含氧酸酸性弱于E的最高价含氧酸
E.D的单质能与E的氢化物反应生成E单质
②请从原子结构角度解释D非金属性比E弱的原因_____ 。
③请设计一个简单的实验证明D非金属性比E弱:_____ 。
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为_____ 。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程:_____ 。
(1)A元素的最高价氧化物的电子式
(2)D元素在周期表的位置是
(3)①下列表述能证明D非金属性比E弱这一事实的有
A.常温下D的单质和E的单质状态不同
B.E的氢化物比D的氢化物稳定
C.一定条件下D和E的单质都能与钠反应
D.D的最高价含氧酸酸性弱于E的最高价含氧酸
E.D的单质能与E的氢化物反应生成E单质
②请从原子结构角度解释D非金属性比E弱的原因
③请设计一个简单的实验证明D非金属性比E弱:
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程:
您最近一年使用:0次
解题方法
3 . 元素周期表的形式多种多样,扇形元素周期表的一部分(1~36号元素)如图所示,对比中学常见的元素周期表,思考扇形元素周期表的填充规律。请用准确的化学符号和用语 回答下列问题:

(1)元素1在元素周期表中的位置_______ 。
(2)比较f、o、k简单离子的半径,由大到小的顺序是_______ (用离子符号表示)。
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式_______ 。
(4)i的最高价氧化物对应水化物的化学式_______ ,比较i、d最简单氢化物的稳定性_______ (用化学式表示)。
(5)比较m、f、g的金属性强弱,由强到弱的顺序是_______ (用元素符号表示)
(6)比较j和h的非金属性强弱,设计简单的实验方案_______ 。

(1)元素1在元素周期表中的位置
(2)比较f、o、k简单离子的半径,由大到小的顺序是
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式
(4)i的最高价氧化物对应水化物的化学式
(5)比较m、f、g的金属性强弱,由强到弱的顺序是
(6)比较j和h的非金属性强弱,设计简单的实验方案
您最近一年使用:0次
4 . 3D打印对钛粉末的要求很高。熔盐电解精炼是制取钛粉的有效途径。精炼时一般采用等摩尔比的KCl-NaCl熔盐,其中含有一定浓度的低价氯化钛(TiClx,x=2、3)。(已知:①熔盐中Ti3+少,Ti2+多熔盐电解精炼制得的钛粉颗粒相对粗大;②钛的熔点为1668℃,TiCl4熔点-24. 1℃、沸点136. 4℃)。
(1)精炼时,粗品质的海绵钛、废钛材等做电解池的_______ 极。
(2)采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:
ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ._______ △H4
①反应ⅳ的化学方程式为_______ 。
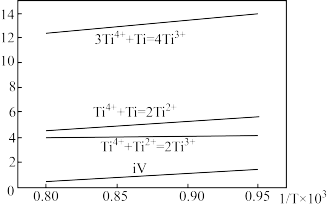
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H1_______ 3△H2(填“>”、“<”或“=”)。
③有助于制取低价钛离子的电解质熔盐的措施为_______ 。
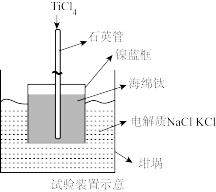
(3)向下图装置中加入海绵钛,从石英管中缓慢加入a mol TiCl4,恒温条件下进行反应。
①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为_______ 。
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=_______ 。
③若向此平衡体系中继续注入TiCl4,则再次平衡后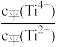
_______ (填“增大”、“减小”或“不变”)
(4)电解精炼制钛粉,偶尔会得到一些相对粗大的钛粉颗粒而影响产品质量,请分析产生的原因_______ (写出1条原因,合理即可。)
(1)精炼时,粗品质的海绵钛、废钛材等做电解池的
(2)采用海绵钛与TiCl4制取低价钛离子的电解质熔盐时,熔盐中存下如下4个反应:
ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ._______ △H4
①反应ⅳ的化学方程式为
②上述4个反应的平衡常数与温度的关系如下图。由此可知△H1

③有助于制取低价钛离子的电解质熔盐的措施为
(3)向下图装置中加入海绵钛,从石英管中缓慢加入a mol TiCl4,恒温条件下进行反应。

①平衡时,测得消耗海绵钛及TiCl4的物质的量分别为b mol、c mol。熔盐中低价钛离子的平均价态为
②用各离子的物质的量分数表示平衡浓度,则反应ⅲ的平衡常数K3=
③若向此平衡体系中继续注入TiCl4,则再次平衡后
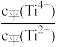
(4)电解精炼制钛粉,偶尔会得到一些相对粗大的钛粉颗粒而影响产品质量,请分析产生的原因
您最近一年使用:0次
2022·广东汕头·一模
解题方法
5 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
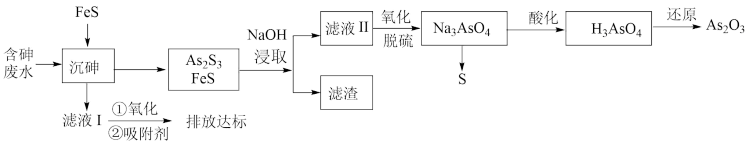
已知:
Ⅰ.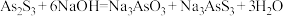
Ⅱ.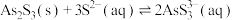
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原
(1) 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”过程中FeS是否可以用过量的 替换
替换___________ (填“是”或“否”);请从平衡移动的角度解释原因:___________ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式___________ 。
(4)用 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有___________ 。
(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。
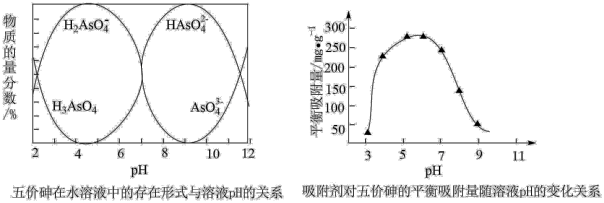
当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因_____ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为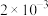 mol/L,则溶液中
mol/L,则溶液中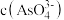 的浓度为
的浓度为_____ mol/L。该处理后的溶液是否符合国家排放标准___________ (填“是”或“否”)。(已知: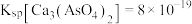 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
已知:
Ⅰ.
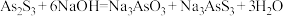
Ⅱ.
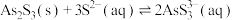
Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原(1)
 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”过程中FeS是否可以用过量的
 替换
替换(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式
(4)用
 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。

当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为
 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为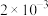 mol/L,则溶液中
mol/L,则溶液中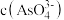 的浓度为
的浓度为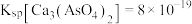 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
您最近一年使用:0次
名校
6 . 前四周期元素X、Y、Z、M的原子序数依次增大。元素X和铝在元素周期表中具有特殊的“对角线”关系,单质及化合物的性质十分相似;Y原子半径在短周期主族元素中最大;Z元素有多种同素异形体,其中一种为正四面体结构,易自燃;M基态原子未成对电子数在同周期元素中最多。
请回答下列问题:
(1)元素Z在周期表中的位置是_______ 。
(2)元素X的氧化物能与Y的氧化物的水化物形成的溶液反应,生成一种四配位化合物,写出该化合物的化学式________ 。
(3)元素Y的氢化物被称作“万能还原剂”,具有强的还原性。其电子式为______ ,遇水可发生反应的化学方程式为________ 。
(4)元素M的名称为_______ ,其+3价氧化物与铝反应的化学方程式为_______ 。
请回答下列问题:
(1)元素Z在周期表中的位置是
(2)元素X的氧化物能与Y的氧化物的水化物形成的溶液反应,生成一种四配位化合物,写出该化合物的化学式
(3)元素Y的氢化物被称作“万能还原剂”,具有强的还原性。其电子式为
(4)元素M的名称为
您最近一年使用:0次



