解题方法
1 . 有A、B、C、D、E五种短周期主族元素,原子序数依次增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D与B同主族且D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
(1)A元素的最高价氧化物的电子式_____ 。
(2)D元素在周期表的位置是_____ ,其简单阴离子的结构示意图为_____ 。B、C、D、E的简单离子半径由小到大的顺序为_____ (用化学式表示)。
(3)①下列表述能证明D非金属性比E弱这一事实的有_____ (填序号)。
A.常温下D的单质和E的单质状态不同
B.E的氢化物比D的氢化物稳定
C.一定条件下D和E的单质都能与钠反应
D.D的最高价含氧酸酸性弱于E的最高价含氧酸
E.D的单质能与E的氢化物反应生成E单质
②请从原子结构角度解释D非金属性比E弱的原因_____ 。
③请设计一个简单的实验证明D非金属性比E弱:_____ 。
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为_____ 。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程:_____ 。
(1)A元素的最高价氧化物的电子式
(2)D元素在周期表的位置是
(3)①下列表述能证明D非金属性比E弱这一事实的有
A.常温下D的单质和E的单质状态不同
B.E的氢化物比D的氢化物稳定
C.一定条件下D和E的单质都能与钠反应
D.D的最高价含氧酸酸性弱于E的最高价含氧酸
E.D的单质能与E的氢化物反应生成E单质
②请从原子结构角度解释D非金属性比E弱的原因
③请设计一个简单的实验证明D非金属性比E弱:
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程:
您最近一年使用:0次
名校
解题方法
2 . 表中列出了8种元素在周期表中的位置,用化学式或元素符号 回答下列问题:
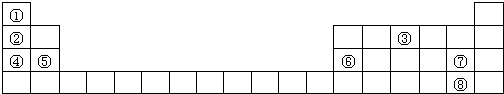
(1)上述元素最高价氧化物对应水化物中,酸性最强的是_______ (化学式)。
(2)①③两元素形成的化合物的电子式为_______ 。
(3)④的单质与水反应的离子方程式是_______ 。
(4)②④⑤原子半径由大到小的顺序是_______ 。
(5)写出⑥⑦两元素构成的化合物在水中发生电离的方程式_______ 。
(6)用电子式表示④与⑦形成化合物的过程_______ 。

(1)上述元素最高价氧化物对应水化物中,酸性最强的是
(2)①③两元素形成的化合物的电子式为
(3)④的单质与水反应的离子方程式是
(4)②④⑤原子半径由大到小的顺序是
(5)写出⑥⑦两元素构成的化合物在水中发生电离的方程式
(6)用电子式表示④与⑦形成化合物的过程
您最近一年使用:0次
解题方法
3 . 元素周期表的形式多种多样,扇形元素周期表的一部分(1~36号元素)如图所示,对比中学常见的元素周期表,思考扇形元素周期表的填充规律。请用准确的化学符号和用语 回答下列问题:

(1)元素1在元素周期表中的位置_______ 。
(2)比较f、o、k简单离子的半径,由大到小的顺序是_______ (用离子符号表示)。
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式_______ 。
(4)i的最高价氧化物对应水化物的化学式_______ ,比较i、d最简单氢化物的稳定性_______ (用化学式表示)。
(5)比较m、f、g的金属性强弱,由强到弱的顺序是_______ (用元素符号表示)
(6)比较j和h的非金属性强弱,设计简单的实验方案_______ 。

(1)元素1在元素周期表中的位置
(2)比较f、o、k简单离子的半径,由大到小的顺序是
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式
(4)i的最高价氧化物对应水化物的化学式
(5)比较m、f、g的金属性强弱,由强到弱的顺序是
(6)比较j和h的非金属性强弱,设计简单的实验方案
您最近一年使用:0次
4 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
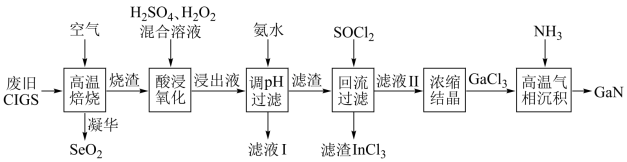
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为_______ ;在化合物 中镓(Ga)和铟(In)均为+3价,则Cu的化合价为
中镓(Ga)和铟(In)均为+3价,则Cu的化合价为_______ 。
(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为_______ 。
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有_______ 和_______ 两种。
(4)滤渣加入 混合前需要洗涤、干燥,并用试剂
混合前需要洗涤、干燥,并用试剂_______ 和_______ 来检验滤渣中的 是否洗净。
是否洗净。
(5)滤渣加入 可反生反应:
可反生反应: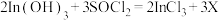 ;对物质X的性质有如下判断,你认为不正确的是 。
;对物质X的性质有如下判断,你认为不正确的是 。
(6)“高温气相沉积”过程中发生的化学反应方程式为_______ 。
 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为
 中镓(Ga)和铟(In)均为+3价,则Cu的化合价为
中镓(Ga)和铟(In)均为+3价,则Cu的化合价为(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有
(4)滤渣加入
 混合前需要洗涤、干燥,并用试剂
混合前需要洗涤、干燥,并用试剂 是否洗净。
是否洗净。(5)滤渣加入
 可反生反应:
可反生反应: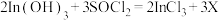 ;对物质X的性质有如下判断,你认为不正确的是 。
;对物质X的性质有如下判断,你认为不正确的是 。| A.有弱酸性 | B.可使溴水褪色 |
C.与 溶液反应得白色沉淀 溶液反应得白色沉淀 | D.与烧碱溶液反应可生成两种盐 |
您最近一年使用:0次
2022-05-13更新
|
240次组卷
|
3卷引用:广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题
广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题湖北省鄂州市部分高中教科研协作体2021-2022学年高一下学期期中考试化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
名校
5 . 下表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为_______ 。
(2)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_______ 。
(3)由元素②和③形成的化学式为(AB)2的化合物的电子式为_______ 。
(4)将由元素④和⑤构成的淡黄色固体化合物投入到含有下列离子的溶液中:NO 、HCO
、HCO 、CO
、CO 、SO
、SO 、SO
、SO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有_______ (填离子符号)。请写出该过程中发生氧化还原反应的离子方程式_______ 。
(5)试比较元素④、⑦的最简单氢化物的沸点高低_______ (用化学式表示)。
(6)能比较元素⑦和⑧非金属性强弱的实验事实是_______ (填字母序号)。
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(3)由元素②和③形成的化学式为(AB)2的化合物的电子式为
(4)将由元素④和⑤构成的淡黄色固体化合物投入到含有下列离子的溶液中:NO
 、HCO
、HCO 、CO
、CO 、SO
、SO 、SO
、SO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(5)试比较元素④、⑦的最简单氢化物的沸点高低
(6)能比较元素⑦和⑧非金属性强弱的实验事实是
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
您最近一年使用:0次
名校
6 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)地壳中含量居于第二位的元素在周期表中的位置是_______ 。
(2)②的最高价氧化物的分子式为____ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出符合要求的一种化合物的电子式_____ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___
A.最高正化合价为+6 B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱 D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为____ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出符合要求的一种化合物的电子式
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是
A.最高正化合价为+6 B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱 D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
解题方法
7 . 下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
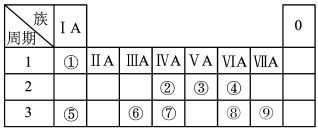
(1)画出元素⑦的原子结构示意图_____________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________ (填化学式)。
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:_______________ 。
(4)写出元素⑤形成的过氧化物的电子式__________________ ;
(5)由表中元素形成的常见物质 X、Y、Z、M、N 可发生以下反应:
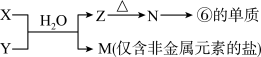
X 溶液与 Y 溶液反应的离子方程式为_____ 。

(1)画出元素⑦的原子结构示意图
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:
(4)写出元素⑤形成的过氧化物的电子式
(5)由表中元素形成的常见物质 X、Y、Z、M、N 可发生以下反应:

X 溶液与 Y 溶液反应的离子方程式为
您最近一年使用:0次
8 . 二氧化碳是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠—钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2→Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O→CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是__________ 。
(2)氧和硫属于同族元素,该族元素的原子最外层电子排布可表示为__________ 。写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________
(3)NaOH的电子式为_____________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式。_____________
(5)钠—钙联合处理法的优点有__________ 、____________ 。(任写两点)
第一步:用NaOH溶液吸收SO2。2NaOH+SO2→Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O→CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是
(2)氧和硫属于同族元素,该族元素的原子最外层电子排布可表示为
(3)NaOH的电子式为
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式。
(5)钠—钙联合处理法的优点有
您最近一年使用:0次
2020-03-11更新
|
159次组卷
|
2卷引用:上海大学附属中学2018-2019学年高三下学期第一次月考化学试题
18-19高一下·山西·阶段练习
名校
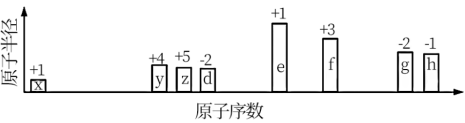
9 . 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)g元素的元素名称为:___________ ;g和d形成的最简单氢化物沸点较高的是:___________ (填化学式);原因是______________________ 。
(2)x分别和d、e形成的个数比为1:1化合物中,所含化学键类型______________ (填“相同”或“不相同”)。
(3)x和e也可以形成化合物,写出其电子式:___________ ;该物质遇水会剧烈反应,生成一种强碱或一种清洁能源气体,写出该反应化学方程式:___________ 。
(4)上述元素可组成盐R: zx4f(gd4)2,向盛有lOmL1mol·L-1R溶液的烧杯中滴加某浓度NaOH溶液,沉淀物质的过随NaOH溶液体积的变化示意图如图:
①写出m点反应的离子方程式:_________________________________ 。
②NaOH溶液浓度为:______________________ 。
③若在R溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________ mol。
根据判断出的元素回答问题:
(1)g元素的元素名称为:
(2)x分别和d、e形成的个数比为1:1化合物中,所含化学键类型
(3)x和e也可以形成化合物,写出其电子式:
(4)上述元素可组成盐R: zx4f(gd4)2,向盛有lOmL1mol·L-1R溶液的烧杯中滴加某浓度NaOH溶液,沉淀物质的过随NaOH溶液体积的变化示意图如图:
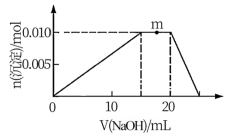
①写出m点反应的离子方程式:
②NaOH溶液浓度为:
③若在R溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
名校
10 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
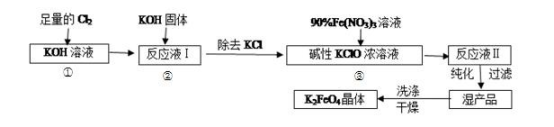

已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
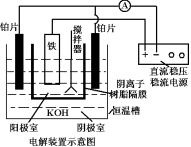
回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式_____ ;恒压滴液漏斗支管的作用_____ ,两水槽中的水为__________ (填“热水”或“冷水”).
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是_____ ;
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:_________________ 。
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是_____________ 。
②如何判断 K2FeO4 晶体已经洗涤干净________________ 。
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为___________ 。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是______________ 。
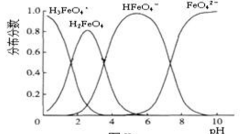
A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O



已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42+10H2O
 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑回答下列问题:实验室可利用如图装置完成流程①和②
(1)写出工业上制取 Cl2 的化学方程式
(2)反应一段时间后,停止通氯气,再往仪器 a 中加入浓 KOH 溶液的目的是
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液 I 中过量的Cl2继续反应,生成更多的KClO
D.KOH 固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:
(4)用重结晶法提纯粗产品:将粗产品先用 KOH 稀溶液溶解,再加入饱和的 KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是
②如何判断 K2FeO4 晶体已经洗涤干净
(5)从环境保护的角度看,制备 K2FeO4 较好的方法为电解法,其装置如图电解过程中阳极的电极反应式为
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是

A.不论溶液的酸碱性如何变化,铁元素都有 4 种存在形态
B.向 pH=10的这种溶液中加硫酸至 pH=2,HFeO4-的分布分数逐渐 增大
C.向 pH=6 的这种溶液中加 KOH 溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
您最近一年使用:0次
2019-01-22更新
|
856次组卷
|
2卷引用:【全国百强校】天津市第一中学2019届高三上学期第三次月考化学试题



