名校
解题方法
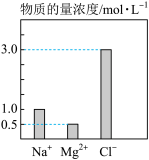
1 . 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有 、
、 、
、 、
、 、
、 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
步骤一:仔细观察,该溶液呈无色、透明、均一状态:
步骤二:加入足量 溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。
溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。
(1)原溶液中除图中的离子外,肯定还含有的离子是_______ ,肯定不含有的离子是_______ 。
(2)步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、干燥。检验沉淀已洗干净的方法是_______ 。
(3)原溶液中 物质的量浓度为
物质的量浓度为_______ mol/L。
(4)向原溶液中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
(5)若向100mL原溶液中加入1mol/L的 溶液,当生成的沉淀质量刚好最大时,加入的
溶液,当生成的沉淀质量刚好最大时,加入的 溶液体积为
溶液体积为_______ L。
 、
、 、
、 、
、 、
、 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
步骤一:仔细观察,该溶液呈无色、透明、均一状态:
步骤二:加入足量
 溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。
溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。(1)原溶液中除图中的离子外,肯定还含有的离子是
(2)步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、干燥。检验沉淀已洗干净的方法是
(3)原溶液中
 物质的量浓度为
物质的量浓度为(4)向原溶液中加入
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(5)若向100mL原溶液中加入1mol/L的
 溶液,当生成的沉淀质量刚好最大时,加入的
溶液,当生成的沉淀质量刚好最大时,加入的 溶液体积为
溶液体积为
您最近一年使用:0次
2022-12-28更新
|
259次组卷
|
4卷引用:陕西省渭南市华阴市2021-2022学年高一上学期期末考试化学试题
陕西省渭南市华阴市2021-2022学年高一上学期期末考试化学试题河南省周口中英文学校2019届高三上学期第三次月考化学试题宁夏平罗中学2022-2023学年高二下学期期中考试化学试题(已下线)第11讲 物质的量浓度-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
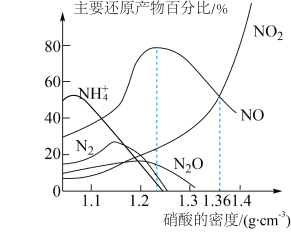
2 . 锌与不同密度的硝酸反应时,主要还原产物的百分比与硝酸的密度的关系如图所示。下列说法正确的是(已知:常温下,50%的硝酸密度约为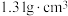 )
)
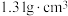 )
)
| A.氮与氧只能形成三种氧化物 |
B.锌与密度为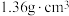 的硝酸反应时,n(消耗 的硝酸反应时,n(消耗 )∶n(消耗 )∶n(消耗 ) )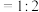 |
C.常温下,50%的硝酸的物质的量浓度约为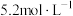 |
D.还原产物中 的百分比随硝酸密度增大而升高 的百分比随硝酸密度增大而升高 |
您最近一年使用:0次
2022-12-21更新
|
116次组卷
|
2卷引用:陕西省商洛市2022-2023学年高三上学期12月联考化学试题
3 . 从2 mol·L-1的氯化铜溶液中取出含3.55 g Cl-的未知质量溶液,所取未知质量溶液的体积是
| A.25 mL | B.50 mL |
| C.12.5 mL | D.7.5 mL |
您最近一年使用:0次
11-12高一上·江西赣州·期中
名校
解题方法
4 . 将100 mL 0.30 mol·L-1的Na2SO4溶液和50 mL 0.20 mol·L-1的Al2(SO4)3溶液混合后,所得溶液中 的物质的量浓度为
的物质的量浓度为
 的物质的量浓度为
的物质的量浓度为| A.0.40 mol·L-1 | B.0.25 mol·L-1 |
| C.0.50 mol·L-1 | D.0.20 mol·L-1 |
您最近一年使用:0次
2022-12-19更新
|
1044次组卷
|
64卷引用:陕西省渭南市澄城县城关中学2019-2020学年高二检测化学试题
陕西省渭南市澄城县城关中学2019-2020学年高二检测化学试题(已下线)2011-2012学年江西省赣州市(十一县市)高一上学期期中联考化学试卷(已下线)2013-2014学年甘肃省嘉峪关市一中高一上学期期中考试化学试卷2014-2015海南省文昌中学高一上学期期末化学试卷2015-2016学年山东省利津一中高一上学期第一次月考化学试卷2015-2016学年山东省文登一中高一上学期第二次诊断性测试化学试卷2015-2016学年浙江省湖州市高一上学期期末化学试卷2017届海南省海口一中高三上10月月考化学试卷贵州省遵义市第四中学2015-2016学年高一上学期期中考试化学试题河南省长葛市第一高级中学2017-2018学年高一9月质量检测化学试题江西省四校协作体2017-2018学年高一上学期期中联考化学试题北京师范大学附属中学2017-2018学年高一上学期期中考试化学试题2018-2019学年高中化学鲁科版必修1章末综合测评题(一)【全国百强校】山东省济南市第一中学2018-2019学年高一上学期10月月考化学试题【全国百强校】湖南省长沙市雅礼中学2018-2019学年高一第一学期12月月考化学试题福建省龙海第二中学2018-2019学年高二下学期期末考试化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高一上学期第一次月考化学试题宁夏青铜峡市高级中学(吴忠中学分校)2020届高三上学期第二次月考化学试题内蒙古包头稀土高新区二中2019-2020学年高一10月月考化学试题上海市金山中学2016-2017学年高一上学期期中考试化学试题海南省定安县定安中学2020届高三上学期第一次月考化学试题吉林省白城市第十四中学2019—2020学年高一上学期期中考试化学试题安徽省阜阳市第三中学2019-2020学年高一上学期第二次调研考试化学试题四川省宜宾市第三中学校2019-2020学年高一上学期10月月考化学试题2020年春季鲁科版高中化学必修1第1章《认识化学科学》测试卷(已下线)上海市建平中学2014-2015学年高一上学期期中考试化学试题江西省赣州市潭口中学2019-2020学年高一上学期第一次月考化学试题福建省三明市尤溪第一中学2019-2020学年高一上学期第一次月考化学试题(已下线)1.3.3物质的量浓度练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册第二章 海水中的重要元素 第三节 物质的量 课时3 物质的量浓度福建省泰宁第一中学2019-2020学年高一上学期第一阶段考试化学试题高一必修第一册(苏教2019版)专题2 第二单元 溶液组成的定量研究 课时1 物质的量浓度溶液的配制与分析山东省滨州市博兴县第三中学2020-2021学年高一上学期第一次月考化学试题福建省泰宁第一中学2020-2021学年高一上学期学分认定暨第一次阶段考试化学试题甘肃省会宁县第一中学2020-2021学年高一上学期期中考试化学试题山东省济南市2020-2021学年高一上学期学情诊断考试化学试题福建省南平市浦城县2019-2020学年高一上学期期中测试化学试题(已下线)专题2.3.3 物质的量浓度(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)第2章第三节第3课时物质的量浓度(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)(已下线)1.3.3 物质的量浓度(包括稀释、混合溶液的计算)-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)甘肃省静宁县第一中学2022届高三上学期第一次月考化学试题(已下线)2.2.2 化学反应的计算-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)山东省济南市2020-2021学年高一上学期10月月考化学试题上海市七宝中学2021-2022学年高一上学期10月月考化学试题上海市徐汇区西南位育中学2021-2022学年高一上学期10月月考化学试题吉林省长春市希望高中2021-2022学年高一上学期期中考试化学试题福建省福州第二中学2021-2022学年高一上学期期中考试化学试题四川省凉山宁南中学2020-2021学年高一上学期期末考试化学试题黑龙江省黑河市五校(嫩江市第一中学,嫩江市职业高中,黑河七中,伊拉哈中学,海江中学)2021-2022学年高一上学期期末联考化学试题上海市延安中学2021-2022学年高一上学期期末考试化学试题(已下线)第15讲 自我检测-【暑假自学课】2022年新高一化学暑假精品课(沪科版2020必修第一册)甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题上海市徐汇区西南位育中学2022-2023学年高一上学期10月月考化学试题四川省凉山宁南中学2020-2021学年高一上学期第一次月考化学试题上海市华东师范大学附属东昌中学2022-2023学年高一上学期12月阶段考化学试题山东省滨州高新高级中学2022-2023学年高一上学期期中考试(3-10班)化学试题山东省滨州高新高级中学2021-2022学年高一上学期期中考试化学试题(A)吉林省通化市梅河口市第五中学2022-2023学年高一上学期期末考试化学试题上海市延安中学 2022-2023学年高一上学期期末考试化学试题作业(十六) 物质的量浓度的有关计算第5课时 物质的量在化学反应中的应用福建省南平市浦城县2022-2023学年高一上学期11月期中化学试题湖南师范大学附属中学2023-2024学年高一上学期期中考试化学试题(已下线)【定心卷】2.3.3 物质的量浓度随堂练习-人教版2023-2024学年必修第一册
5 . 根据所学知识回答问题
(1)___________ molH2O中所含有的氧原子数与1.5 molCO2的氧原子数相同。
(2)质量为9.8g的H2SO4物质的量是___________ 。
(3)1.204×1024个H2的物质的量是___________ 。
(4)配制溶液时,称量5.85gNaCl固体,配制480mL溶液,则溶液物质的量浓度是___________ mol/L。
(5)标准状况下16gH2的体积是___________ L。
(6)100mL0.2mol·L-1的Na2SO4溶液中,取出10mL该溶液,c(Na+)=___________ ,将该10mL溶液加水稀释至100mL,则c(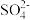 )=
)=___________ 。
(7)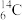 的中子数是
的中子数是___________ 。
(8)写出方程式的系数____NaClO+___NaI=____NaIO3+____NaCl___________
(1)
(2)质量为9.8g的H2SO4物质的量是
(3)1.204×1024个H2的物质的量是
(4)配制溶液时,称量5.85gNaCl固体,配制480mL溶液,则溶液物质的量浓度是
(5)标准状况下16gH2的体积是
(6)100mL0.2mol·L-1的Na2SO4溶液中,取出10mL该溶液,c(Na+)=
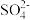 )=
)=(7)
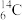 的中子数是
的中子数是(8)写出方程式的系数____NaClO+___NaI=____NaIO3+____NaCl
您最近一年使用:0次
名校
6 . 表示溶液组成的方法有多种:溶质的质量分数、体积比浓度、物质的量浓度等,因此在配制溶液时,根据不同的需要,有不同的配制方法,如:(请完成填空)
I.用10%的氢氧化钠溶液(密度为1.01g/cm3)配制成27.5g2%的氢氧化钠溶液。
(1)需量取_____ mL蒸馏水注入烧杯中,然后再注入_____ g10%氢氧化钠溶液混合均匀。
II.用质量分数为36.5%盐酸(密度为1.16g/cm3)配制1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(2)配制稀盐酸时,应选用容量为___________ mL的容量瓶。
(3)计算已知盐酸的物质的量浓度为___________ 。
(4)经计算需要___________  浓盐酸,在量取时宜选用下列量筒中的
浓盐酸,在量取时宜选用下列量筒中的___________ 。
A.5mL B.10mL C.25mL D.50mL
(5)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入相应规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是___________ (填序号)。
(6)在上述配制过程中,定容时俯视刻度线,其配制的稀盐酸浓度是__________ (填“偏高”、“偏低”或“无影响”);若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是______ (填“偏高”、“偏低”或“无影响”)。
I.用10%的氢氧化钠溶液(密度为1.01g/cm3)配制成27.5g2%的氢氧化钠溶液。
(1)需量取
II.用质量分数为36.5%盐酸(密度为1.16g/cm3)配制1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(2)配制稀盐酸时,应选用容量为
(3)计算已知盐酸的物质的量浓度为
(4)经计算需要
 浓盐酸,在量取时宜选用下列量筒中的
浓盐酸,在量取时宜选用下列量筒中的A.5mL B.10mL C.25mL D.50mL
(5)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入相应规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(6)在上述配制过程中,定容时俯视刻度线,其配制的稀盐酸浓度是
您最近一年使用:0次
名校
解题方法
7 . 将agFe2O3、Al2O3样品溶解在过量的200mL0.1mol/L的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
| A.0.1mol/L | B.0.2mol/L | C.0.4mol/L | D.0.8mol/L |
您最近一年使用:0次
8 . 小铭将wgNaCl晶体完全溶于1L水中,溶解和电离过程如图所示。下列说法正确的是
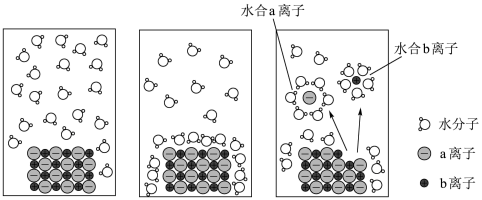

| A.a离子为Cl-,b离子为Na+ |
| B.溶解和电离过程中,水分子与晶体不存在相互作用 |
C.所得溶液中c(Na+)等于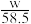 mol/L mol/L |
| D.若向溶液中再加入NaCl固体,离子浓度不再变化时,则所得为饱和溶液 |
您最近一年使用:0次
9 . 现有CO和CO2的混合气体,在标准状况下的体积为11.2L。请回答下列问题:(用NA表示阿伏加德罗常数的值)
(1)该混合气体总的物质的量为_______ 。
(2)混合气体中碳原子的个数为_______ 。
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。
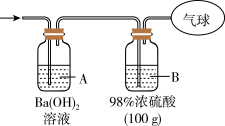
①从A瓶中获得沉淀的化学反应方程式_______ 。
②Ba(OH)2溶液浓度的测定。步骤如下:
a.过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b.将B瓶中的溶液配成1L溶液
c.将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为_______ 。原Ba(OH)2溶液的浓度为_______ 。
③气球中收集到的气体的质量为_______ 。
(1)该混合气体总的物质的量为
(2)混合气体中碳原子的个数为
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。

①从A瓶中获得沉淀的化学反应方程式
②Ba(OH)2溶液浓度的测定。步骤如下:
a.过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b.将B瓶中的溶液配成1L溶液
c.将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为
③气球中收集到的气体的质量为
您最近一年使用:0次
2022-12-12更新
|
295次组卷
|
2卷引用:陕西省西安市第八十三中学2022-2023学年高一上学期第二次月考化学试题
10 . 设NA为阿伏加德罗常数的值.下列叙述正确的是
| A.78gNa2O2固体中含有的阴离子数为2NA |
| B.27g铝被完全氧化成氧化铝,失去3NA个电子 |
| C.标准状况下,22.4 L苯含有NA个C6H6分子 |
| D.1mol/L CaCl2溶液中含有的氯离子数目为2NA |
您最近一年使用:0次



