1 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
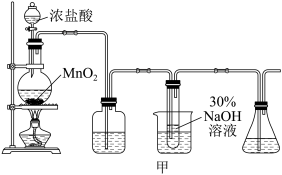
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为____ mL,此过程所需玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和____ 。
(2)甲图装置C试管内发生主要化学反应的离子方程式为____ 。
Ⅱ.乙图是尿素法生产水合肼的装置
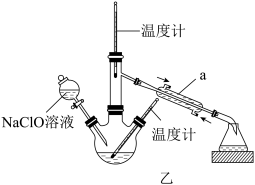
(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用____ 的方式降温,并控制低温(低于20℃)进行反应。温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L-1,其反应的化学方程式为_____ 。反应结束后,收集108~1149℃馏分。
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为____ 。(保留两位有效数字)
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是____ 。
(6)①写出硫酸肼第二步水解反应的离子方程式:____ 。
②硫酸肼水溶液中离子浓度关系表达正确的是____ (填英文字母)。
A.c(SO )=c(N2H
)=c(N2H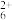 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)
B.c(SO )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H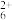 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)
D.c(SO )>c(N2H
)>c(N2H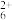 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为
(2)甲图装置C试管内发生主要化学反应的离子方程式为

Ⅱ.乙图是尿素法生产水合肼的装置

(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是
(6)①写出硫酸肼第二步水解反应的离子方程式:
②硫酸肼水溶液中离子浓度关系表达正确的是
A.c(SO
 )=c(N2H
)=c(N2H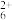 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)B.c(SO
 )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)C.2c(N2H
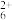 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)D.c(SO
 )>c(N2H
)>c(N2H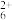 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
您最近一年使用:0次
2010·上海·二模
2 . 过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为c mol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
(1)计算稀硫酸的物质的量浓度___ 。
(2)通过计算确定过碳酸钠的化学式___ 。
(3)工业上常以所含活性氧的质量分数[w(活性氧)= ×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品___ 。(已知:2Na2S2O3+I2→Na2S4O6+2NaI)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
(1)计算稀硫酸的物质的量浓度
(2)通过计算确定过碳酸钠的化学式
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
 ×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
您最近一年使用:0次



